
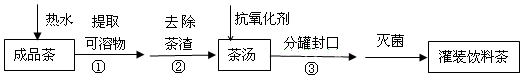
| A. | ①是萃取 | B. | ②是过滤 | ||
| C. | ③是分液 | D. | 维生素C可作抗氧化剂 |
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
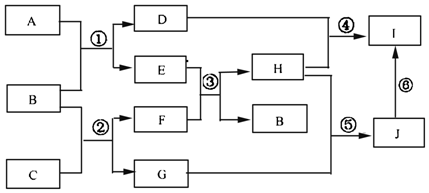
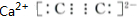 .
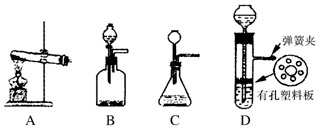
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期的ⅡA族与ⅢA族元素的原子序数一定相差1 | |
| B. | 镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素 | |
| C. | 元素的非金属性越强,其气态氢化物水溶液的酸性越强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
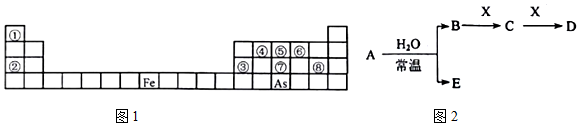
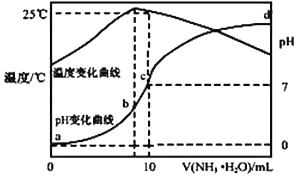
 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
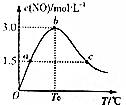
 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a 点 Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b 点:c(NH4+)>c(Cl-)>c(H +)>c(OH -) | |
| D. | 25℃时 NH4Cl 水解常数为(10n-1)×10-7mol•L-1(用 n 表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com