
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为_______反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____℃。该温度下,若向该容器中充入n(CO2)=1mol, n(H2)=1mol,4min末达到平衡,CO2的转化率为_______;H2的体积分数为________________。
(4)写出增大逆反应速率的措施:___________________;(至少写两种)
【答案】 吸热 BC 830 50% 25% 增加CO 升温 加入催化剂
【解析】(1)根据表中数据可知随着反应的进行平衡常数逐渐增大,这说明升高温度平衡向正反应方向进行,该反应为吸热反应。(2)A.反应前后体积不变,压强始终不变,因此容器中压强不变不能说明达到平衡状态,A错误;B.混合气体中c(CO)不变说明达到平衡状态,B正确;C.v正(H2)=v逆(H2O)说明正逆反应速率相等,达到平衡状态,C正确;D.c(CO2)=c(CO)不能说明正逆反应速率相等,不一定处于平衡状态,D错误,答案选BC;(3)此时浓度熵是c(CO)·c(H2O)/c(CO2)·c(H2)=1,根据表中数据可知此时的温度为830℃。由于反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则根据方程式可知
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol) 1 1 0 0
转化量(mol) x x x x
平衡量(mol) 1-x 1-x x x
则根据平衡常数可知![]() ,解得x=0.5,所以CO2的转化率为50%;H2的体积分数为
,解得x=0.5,所以CO2的转化率为50%;H2的体积分数为![]() ;
;
(4)根据外界条件对反应速率的影响可知升高温度或增大压强可以增大逆反应速率。


科目:高中化学 来源: 题型:
【题目】有一无色未知溶液中检验出有Ba2+、Ag+ , 同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Fe3+ ③Cl﹣ ④NO ![]() ⑤S2﹣ ⑥CO
⑤S2﹣ ⑥CO ![]() ⑦NH
⑦NH ![]() ⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
A.③⑤⑥⑦⑨
B.①②⑤⑥⑧
C.③④⑦⑧⑨
D.①②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
2015年我国自主研制的C919大型客机正式下线,标志着我国成为世界上少数几个掌握研发制造大型客机能力的国家,同时意味着中国高端装备制造业发展到一个全新的高度。
(1)飞机的外壳通常采用镁、铝、钛合金材料,钛的价电子排布图为__________,第一电离能:镁 _________铝(填“大于”或“小于”)。
(2)Fe与CO能形成配合物羰基铁[Fe(CO)5],该分子中σ键与π键个数比为________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
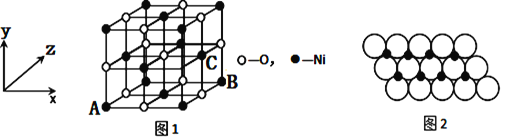
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。
(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为从铝土矿(Al2O3、Fe2O3、泥沙)提取铝的流程图(注:整个流程中,不考虑泥沙的溶解及有关反应;C可以用来治疗胃酸过多):
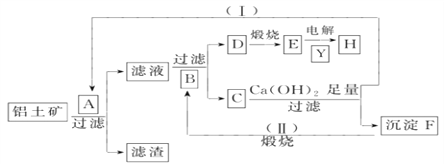
(1)A溶质的化学式___________;B的结构式____________,Y的名称_____________。
(2)写出①C与Ca(OH)2稀溶液反应的离子方程式: __________________________________。
②F→B的反应方程式: ______________________________。
(3)操作(Ⅰ)、(Ⅱ)在工业生产中的意义________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023 , 则此时在阴极上析出铜的质量是( )
A.8g
B.16g
C.32g
D.64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将wg镁粉和铝粉的混合物溶于足量的盐酸中,再和过量的NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热灼烧,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )
A.30%
B.40%
C.50%
D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质描述正确的是( )
A.Fe(OH)3溶于氢碘酸生成FeI3
B.Na与CuSO4水溶液反应析出Cu
C.Fe和水蒸气高温下生成Fe2O3
D.稀盐酸与Na2SiO3溶液混合产生H2SiO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com