
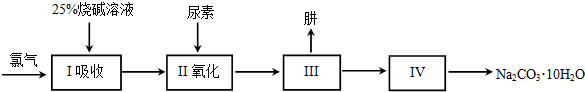
分析 (1)氯气溶于水后大部分氯气仍然以氯气分子形式存在,少部分氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质部分电离,依据氯水的成分解答;
(2)根据方程式的书写和相对分子质量的计算考虑;
(3)次氯酸钠的氧化性强于氯酸钠;
(4)Na2CO3•10H2O中含有含有氯离子;
(5)碳酸钠能与盐酸反应生成二氧化碳.
解答 解:(1)氯气和水反应的方程式:Cl2+H2O=HClO+HCl,氯水的成分:Cl2、HCl、H2O,H+、Cl-、ClO-、OH-,具有强氧化性的含氯元素的微粒为:Cl2、HClO、ClO-,故答案为:Cl2、HClO、ClO-;
(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式Cl2+2OH-→ClO-+Cl-+2H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160,$\frac{160}{0.25}$=640,故答案为:Cl2+2OH-→ClO-+Cl-+2H2O;640;
(3)次氯酸钠的氧化性强于氯酸钠,温度高时生成氯酸钠,低温可节省能源,故答案为:次氯酸钠的氧化性强于氯酸钠;节省能源;
(4)Na2CO3•10H2O中含有含有氯离子,实验室用硝酸酸化的硝酸银溶液检验氯离子,故答案为:稀硝酸、硝酸银溶液;
(5)碳酸钠能与盐酸反应生成二氧化碳,根据二氧化碳的体积能确定碳酸钠的物质的量,然后可求出Na2CO3•10H2O的纯度,故答案为:反应前固体总质量、气体体积.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度不大.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | PH3分子呈三角锥形 | B. | PH3分子是极性分子 | ||
| C. | 键能:P-H>N-H | D. | PH3在空气中易自燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总键能低于生成物的总键能 | |
| B. | 1mol I2(g)中通入1mol H2(g),反应放热11kJ | |
| C. | 等物质的量时,I2(g)具有的能量低于I2(l) | |
| D. | 平衡时分离出HI(g),正反应速率先减小后增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 | |
| B. | 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 | |
| C. | 洗涤的操作是向过滤器里的固体加洗涤剂,使洗涤剂浸没固体,待洗涤剂自然流下 | |
| D. | 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
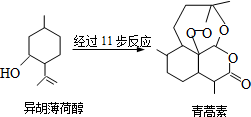 屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 每个青蒿素分子中只含4个六元环 | |
| C. | 异胡薄荷醇可发生消去和加成反应 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
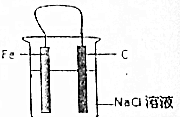 有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )
有关Fe-C-Nac1溶液构成的原电池中,叙述错误的是( )| A. | 铁片为负极,碳棒为正极 | |
| B. | 铁被腐蚀,碳棒上有氯气放出 | |
| C. | 碳棒附近的溶液可使酚酞变红 | |
| D. | 导线上有电流通过,电流方向是由碳极流向铁极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com