
| | ① | ② | ③ | ④ | ⑤ |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |


科目:高中化学 来源:不详 题型:单选题
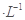 NaOH溶液中逐滴加入。0.2mol
NaOH溶液中逐滴加入。0.2mol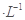 CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是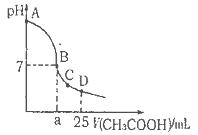
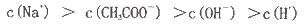
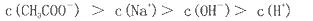
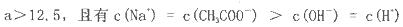
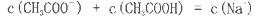
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32- |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D.温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 ·L-1
·L-1 0.1mol·L-l
0.1mol·L-l查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.HA的电离方程式为: |
B.不考虑其他组的实验结果, |
C.③组实验中,混合溶液中 |
D.①组实验中,混合溶液中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
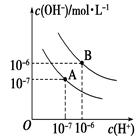
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是| A.由蓝色变为粉红色 | B.红色加深 |
| C.由粉红色变为蓝色 | D.蓝色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com