
| A、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B、c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C、c(Na+)>c (OH-)>c(CH3COO-)>c(H+) |
| D、c(Na+)>c (OH-)>c(H+)>c(CH3COO-) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、0.1molCl2常温下与过量NaOH溶液反应转移电子总数为0.1NA |
| B、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| C、0.25molNa2O2中含有的阴离子数为0.5NA |
| D、18gD2O(重水)完全电解,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
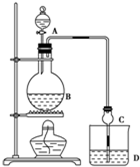 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
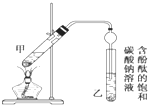 某学生在实验室制取乙酸乙酯的主要步骤如下:
某学生在实验室制取乙酸乙酯的主要步骤如下:| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCO3-)>c(CN- )>c(OH- ) |
| B、c(CN- )>c(HCO3-)>c(H+ ) |
| C、c(HCN)+c(CN- )=c(HCO3-)+c(H2CO3) |
| D、c(Na+ )+c(H+ )=c(HCO3- )+c(CN- )+C(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
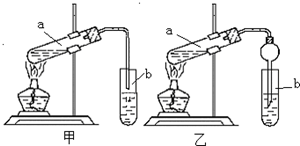 某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:
某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
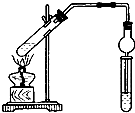 用如图所示实验装置制取乙酸乙酯.回答以下问题:
用如图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 6 4 2 3 8 |
| B、2 4 3 2 2 6 |
| C、2 0 1 2 0 2 |
| D、2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 出发来合成A,其合成路线如图:
出发来合成A,其合成路线如图:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com