
| A. | 正、逆反应速率都减小 | B. | 正、逆反应速率都增大 | ||
| C. | 逆反应速率增大,正反应速率减小 | D. | 逆反应速率减小,正反应速率增大 |
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硫酸反应生成的白色固体是CuSO4 | |
| B. | ①中灰白色固体不可能含有CuO | |
| C. | ②中的黑色固体可能含有CuS或Cu2S | |
| D. | ④中所得的白色沉淀是BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
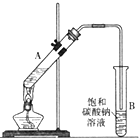 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
如图为反应Fe + CuSO4 === FeSO4 + Cu中电子转移的关系图,则图中的元素甲、乙分别表示
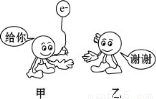
A.Fe Cu
B.Cu S
C.Fe O
D.Fe S
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数KW | B. | 可逆反应的平衡常数K | ||
| C. | 0.1mol/LCH3COONa溶液的pH | D. | NH3•H2O的电离常数Kb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁的金属活动性比铷强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性比RbCl弱 | |
| D. | Rb单质比RbCl更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
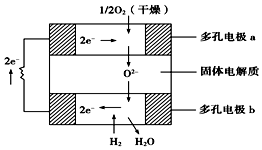 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | b极的电极反应式为H2+O2--2e-═H2O | |
| C. | a极对应的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 氧化锆的作用是让电子在电池内部通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 | |
| B. | SO3溶于水能导电,所以它是电解质 | |
| C. | 胶体中分散质微粒能透过滤纸不能透过半透膜 | |
| D. | 不与酸反应的氧化物一定会跟碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com