
| A. | CuO+2H+═Cu2++H2O | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | Fe+2H+═Fe2++H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
分析 A.氧化铜为难溶于水的物质,写化学式;
B.碳酸钙与强酸反应生成可溶性盐、二氧化碳和水的一类反应,
C.铁和非强氧化性的强酸反应生成亚铁盐和氢气;
D.氢氧化钡为二元强碱,完全电离,需拆写成离子.
解答 解:A.氧化铜与强酸反应生成易溶于水的盐,CuO+2H+═Cu2++H2O,左右电荷守恒、原子守恒,离子方程式正确,故A不选;
B.CaCO3+2H+=Ca2++CO2↑+H20,可表示碳酸钙与强酸反应,生成产物为可溶性盐、二氧化碳和水,左右电荷守恒、原子守恒,离子方程式正确,故B不选;
C.Fe+2H+═Fe2++H2↑,可表示铁和非强氧化性的强酸反应,左右电荷守恒、原子守恒,离子方程式正确,故C不选;
D.Ba(OH)2+2H+═Ba2++2H2O,为二元强碱氢氧化钡和强酸的反应,氢氧化钡应拆写成离子,正确的离子方程式为:OH-+H+═H2O,故D选;
故选D.
点评 本题考查离子反应方程式的书写,明确发生的化学反应并遵循客观事实、离子方程式的书写方法等即可解答,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
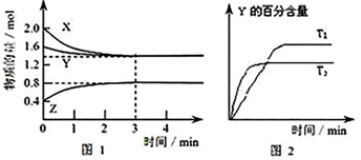
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L•min) | |
| C. | 据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与碱溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与酸溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.
,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
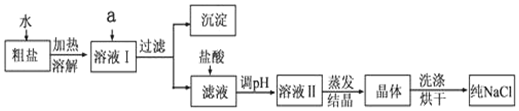
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 | |
| B. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3 COO -) | |
| C. | 在氯水中通入氯化氢气体后,溶液中c(HClO)减小 | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com