
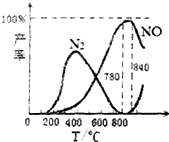
| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |
分析 A.利用盖斯定律书写热化学方程式;
B.燃烧热为1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
C.从转化率的大小与温度的关系选择反应的适宜温度;
D.用铂丝做催化剂,利用反应①来先制备NO,再制备硝酸.
解答 解:A.根据盖斯定律,$\frac{1}{2}$(①-②)得N2(g)+O2(g)?2NO(g)△H=$\frac{1}{2}$[-905kJ/mol-(-1268kJ/mol)]=+181.5kJ/mol,故A正确;
B.燃烧热为1mol可燃物完全燃烧生成稳定氧化物时放出的热量,根据给定的方程式得不到氨气燃烧热的热方程式,不能计算,故B错误;
C.从图象可以看在,反应温度在在780~840℃之间,NO的产率最大,故C正确;
D.用铂丝做催化剂,根据反应和图象,升高温度,NO的产率较高,利用反应①来先制备NO,再制备硝酸,故D正确;
故选B.
点评 本题考查化学平衡影响元素、反应热的计算等问题,难度不大,注意对题中图象的分析控制不同的温度获得不同的主要产物.


科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+02(g)=2H20(1)△H=-285kJ•mol-1 | |
| B. | 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多 | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应转移电子的数小于0.6×6.02×1023 | |
| D. | 已知中和热为57.3kJ•mol-1,若将含0.5molH2S04的浓硫酸溶液与含1mol Na0H的溶液混合,放出的热量要小于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
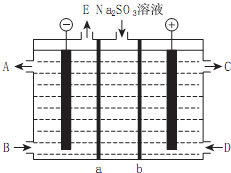
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
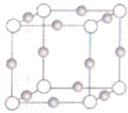 Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
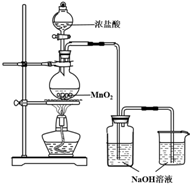 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.| 操作 | 现象 |
| A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5ml,pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com