
![]()
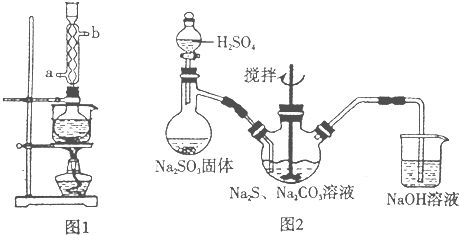
(1)样品中加入铁粉后所发生反应的化学方程式为___________。
(2)用于检验溶液A中杂质已除去的试剂是___________;操作方法是____________________。
(3)加入KOH溶液的目的是_______________________________________________________。
(4)过滤后,对得到的KI溶液还必须进行的一项实验操作是____________________________。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
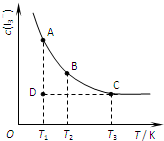 实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )| A、该反应的正反应为放热反应 | B、A状态与C状态的化学反应速率大小为v(A)>v(C) | C、D状态时,v正>v逆 | D、欲配制浓度较大的氯水,可将氯气通入氯化钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
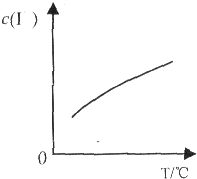 已知:I2与KI溶液发生如下反应:I2(aq)+I-(aq)?I3-(aq),达到平衡后溶液中I-的平衡浓度c(I-)随温度T的变化如图所示.下列有关说法正确的是
已知:I2与KI溶液发生如下反应:I2(aq)+I-(aq)?I3-(aq),达到平衡后溶液中I-的平衡浓度c(I-)随温度T的变化如图所示.下列有关说法正确的是| A、固体碘微溶于水,实验室配制较浓“碘水”时,可将固体碘溶于一定浓度的KI溶液中 | B、反应I2(aq)+I-(aq)?I3-(aq)的△H>0 | C、在I2的KI水溶液中加入CCl4或H2O2均可使溶液中c(I3-)增大 | D、依此原理,Cl2在一定浓度的NaCl溶液中溶解度增大 |
查看答案和解析>>
科目:高中化学 来源:福建省长泰一中2009-2010学年高二上学期期末考试化学(理科)试卷 题型:022
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-![]() I3-上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态).
I3-上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态).
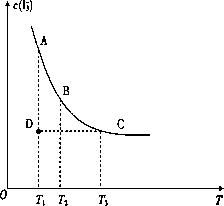
(1)通过分析上图,该反应的正反应为________反应(填吸热或放热),
(2)A状态与C状态的化学反应速率比较为v(A)________v(C)(填>、<或=).
(3)在T1、D状态时,v正________v逆(填>、<或=).
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
 NaCl(l)+K(g) ΔH>0,该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见下表.
NaCl(l)+K(g) ΔH>0,该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见下表. 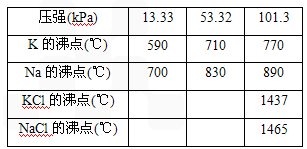
 I3- 上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
I3- 上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态). 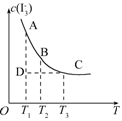
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com