
| A. | 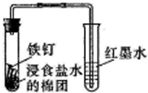 观察铁的吸氧腐蚀 | B. | 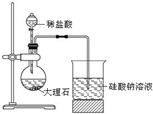 比较氯、碳、硅的非金属性 | ||
| C. | 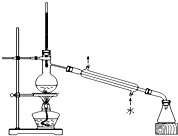 实验室蒸馏石油 | D. | 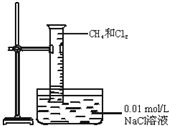 甲烷与氯气的取代反应 |
分析 A.食盐水为中性,发生吸氧腐蚀,右侧红墨水沿着导管上升;
B.盐酸易挥发,盐酸与硅酸钠溶液反应;
C.蒸馏中温度计测定馏分温度、冷却水下进上出;
D.0.01mol/L食盐水不是饱和溶液,氯气可溶解,且该实验需要光照.
解答 解:A.如果Fe发生吸氧腐蚀,会导致左边试管中压强减小,右边试管导气管中液面会上升,所以图中装置可观察铁的吸氧腐蚀,故A正确;
B.盐酸易挥发,盐酸与硅酸钠溶液反应,则图中装置不能比较碳、硅的非金属性,故B错误;
C.蒸馏中温度计测定馏分温度、冷却水下进上出,则图中蒸馏实验装置合理,故C正确;
D.0.01mol/L食盐水不是饱和溶液,氯气可溶解,且该实验需要光照,则试管中液面上升也不能验证取代反应的发生,故D错误;
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,涉及电化学腐蚀、混合物分离提纯实验、常见有机物性质等,把握物质的性质及实验装置图的作用、反应原理为解答的关键,注意实验方案的评价性、操作性分析,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为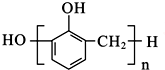 | |
| C. | 醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物 | |
| D. | 迷迭香酸的结构为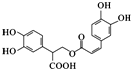 它可以发生酯化、水解但不能加成反应. 它可以发生酯化、水解但不能加成反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
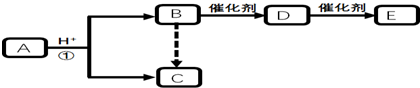
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
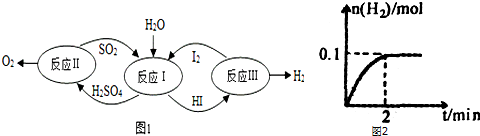
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧RbH时,火焰有特殊颜色 | |
| B. | RbH中H+半径比Li+半径小 | |
| C. | 跟液氨反应时,有RbNH2生成 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3为离子化合物 | B. | Mg与Cl形成共价键 | ||
| C. | SiCl4为共价化合物 | D. | K与Mg 形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com