
【题目】恒温恒压下,对于反应:A(g)+3B(g)![]() 3C(g),达到平衡状态的标志是( )
3C(g),达到平衡状态的标志是( )
A.v正(A)=3v逆(C)
B.密闭容器内气体的密度不再改变
C.单位时间内消耗3nmolC的同时,生成3n molB
D.密闭容器内A、B、C气体的浓度之比为1:3:2
【答案】B
【解析】
A.在任何时刻都存在3v正(A)=v正(C),现在v正(A)=3v逆(C),则v正(C)= 3v正(A)=9v逆(C),说明反应正向进行,未处于平衡状态,A错误;
B.该反应是前后气体体积不等的反应,若未达到平衡,则气体的密度会发生变化,所以密闭容器内气体的密度不再改变,说明反应达到了平衡状态,B正确;
C.单位时间内消耗3nmolC的同时,生成3n molB表示的都是反应逆向进行,不能据此判断反应是否处于平衡状态,C错误;
D.密闭容器内A、B、C气体的浓度之比为1:3:2可能处于平衡状态,也可能不是平衡状态,这与开始时加入的物质的多少及反应条件有关,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
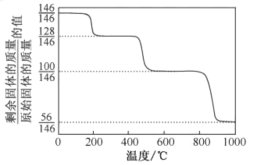
①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
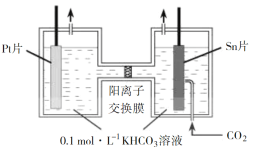
①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.1000 mol·L1 NaOH 溶液分别滴定 20.00 mL 0.1000 mol·L1 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
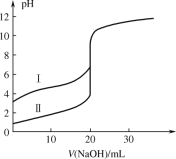
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH) = 10.00 mL 时,醋酸溶液中c(CH3COOH)<c(CH3COO)
C.pH = 7 时,滴定盐酸消耗的 NaOH 溶液体积小于滴定醋酸消耗的 NaOH 溶液体积
D.V(NaOH) = 20.00 mL 时,两溶液中 c(CH3COO)=c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,弱酸H2A溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ[δ(X)=![]() ]随溶液pH变化的关系如图所示,下列说法错误的是
]随溶液pH变化的关系如图所示,下列说法错误的是
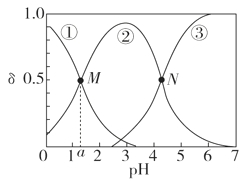
A.pH>4的溶液中,δ(A2-)= ,
,
B.M点对应的溶液中水的电离程度小于N点
C.若图中a为1.2,则lg [Ka1(H2A)]=-1.2
D.曲线②代表的粒子是HA-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为33 ℃)。工业上可用硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如下:
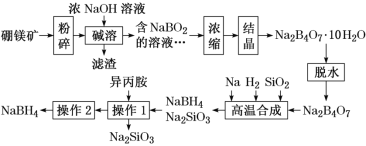
回答下列问题:
(1)NaBH4中氢元素的化合价为_______。
(2)碱溶时Mg2B2O5发生反应的化学方程式是________。
(3)滤渣的主要成分是_____。
(4)高温合成中,加料之前需将反应器加热至100 ℃以上,并通入氩气。通入氩气的目的是_____。
(5)操作2的名称为______,流程中可循环利用的物质是_____。
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,电解总反应的离子方程式为_______。

(7)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 g NaBH4的还原能力相当于_____g H2的还原能力(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列说法不正确的是
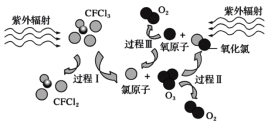
A.过程Ⅰ中断裂极性键C—Cl键
B.过程Ⅲ中O+O == O2是吸热过程
C.过程Ⅱ可表示为O3+Cl==ClO+O2
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)=Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
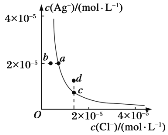
A. 加入AgNO3可以使溶液由c点变到d点
B. 加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C. d点有AgCl沉淀生成
D. a点对应的Ksp小于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.2C6H6 + 15O2![]() 12CO2 +6H2O
12CO2 +6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
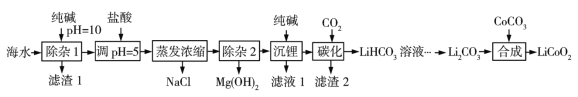
已知如下信息:①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示。
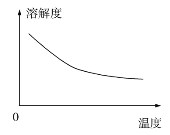
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为____________ ,滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和____________________(填化学式)。
(2)调pH=5的目的是________________________。
(3) “沉锂”包括过滤、洗涤等,宜用_____________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 | n(Na2CO3)/n(LiCl) | 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 0.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______________(填序号)方案投料。
(4) “除杂2”中调pH=13时c(Mg2)=_______________mol·L1。
(5) “合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com