
【题目】为测定人体血液中Ca2+的含量,设计了如下方案:
![]()
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
A.0.001mol·L-1B.0.0025mol·L-1 C.0.0003mol·L-1D.0.0035mol·L-1
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加![]() 溶液,观察铁钉周围出现蓝色沉淀的快慢
溶液,观察铁钉周围出现蓝色沉淀的快慢
B.将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛
C.欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂![]() 或试纸
或试纸![]() 为:中和滴定实验、pH试纸
为:中和滴定实验、pH试纸
D.从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量![]() 溶液氧化,最后加入
溶液氧化,最后加入![]() 萃取分离
萃取分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子二次电池正极材料磷酸亚铁锂是应用广泛的正极材料之一。一种制备磷酸亚铁锂的化学方法为:C+4FePO4+2Li2CO3![]() 4LiFePO4+3CO2↑.回答下列问题:
4LiFePO4+3CO2↑.回答下列问题:
(1)Fe失去电子变成为阳离子时首先失去______轨道的电子。
(2)C、O、Li原子的第一电离能由大到小的顺序是______;PO43-的空间构型为______。
(3)C与Si同主族,CO2在高温高压下所形成的晶体结构与SiO2相似,该晶体的熔点比SiO2晶体______(填“高”或“低”)。硅酸盐和SiO2一样,都是以硅氧四面体作为基本结构单元,下图表示一种含n个硅原子的单链式多硅酸根的结构(投影如图1所示),Si原子的杂化类型为______,其化学式可表示为______。
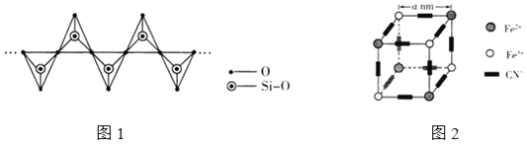
(4)图2表示普鲁士蓝的晶体结构(![]() 个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
①普鲁士蓝晶体中每个Fe3+周围最近且等距离的Fe2+数目为______个。
②晶体中该立方体的边长为a nm,设阿伏加德罗常数为NA,其晶体密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是 ( )
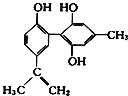
A.该分子中的所有碳原子可能共平面
B.该物质在一定条件下能发生加聚反应
C.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
D.1 mol该物质与足量浓溴水反应时最多消耗Br2为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器使用方法或实验操作正确的是![]()
A.洗净的锥形瓶和容量瓶可以放进烘箱烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:

(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知水的电离方程式是H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.水的电离程度只受温度的影响
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.粒子![]() 对水的电离平衡不会产生影响
对水的电离平衡不会产生影响
D.向水中加入少量固体NH4Cl,平衡向逆反应方向移动,pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.NaClO溶液中通入少量CO2,ClO﹣水解程度增大,溶液碱性增强
B.铁片镀锌时,铁片与外电源的正极相连
C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则ΔH<0
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)![]() NO(g)+SO3(g),通入少量O2,
NO(g)+SO3(g),通入少量O2,![]() 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com