
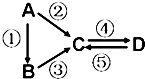
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:分析 (1)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2.B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,B为NH3,依据推断出的物质书写化学方程式;
(2)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,依据推断出的物质判断;
(3)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;
(4)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2;
(5)若A为淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质,B与C可反应生成A,则A为S,B为H2S,C为SO2,D为SO3,据此答题.
解答 解:(1)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2.B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,B为NH3,③反应的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O;
(2)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,单质A为Al,元素在周期表中的位置是第三周期ⅢA族,A→C的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;B→C的离子方程式为:SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(4)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2,C的溶液用于蚀刻印刷铜电路板,C→D的离子方程式为:Fe+2Fe3+═3Fe2+,
故答案为:Fe+2Fe3+═3Fe2+;
(5)若A为淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质,B与C可反应生成A,则A为S,B为H2S,C为SO2,D为SO3,H2S的燃烧热为586.16KJ/mol,所以H2S的燃烧热的热的化学方程式为H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(l)△H=-586.16KJ/mol,
故答案为:H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(l)△H=-586.16KJ/mol.
点评 本题考查了物质转化关系的应用和性质应用,主要考查硫及其化合物性质、氮及其化合物、硅及其化合物、铁及其化合物性质的综合应用,用好条件是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某蓝色溶液中加NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ | |
| B. | 某溶液中加BaCl2溶液,生成白色沉淀,继续滴加稀硝酸沉淀不溶解,说明原溶液中有SO42- | |
| C. | 某溶液中加硝酸银溶液,生成白色沉淀,继续滴加稀硝酸有部分沉淀不溶解,说明原溶液中一定有Cl- | |
| D. | 某溶液中加稀硫酸溶液生成无色无味气体,该气体能使澄清石灰水变浑浊,说明原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(4{×10}^{-9}+1{×10}^{-12})}{5}$ | B. | $\frac{(8{×10}^{-9}+1{×10}^{-12})}{5}$ | ||
| C. | 5×10-10 | D. | 5×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
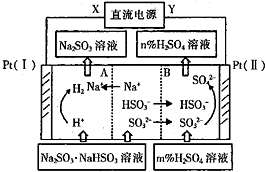
| A. | Pt(Ⅱ)为阳极 | B. | 阳极区[H+]增大 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑧ | B. | ②③④⑤⑥⑦ | C. | ③⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com