
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______,电子数为________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为_____________________________________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
_______________________________________________________。
(6)在硅酸盐中,SiO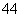 四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网
四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网 状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
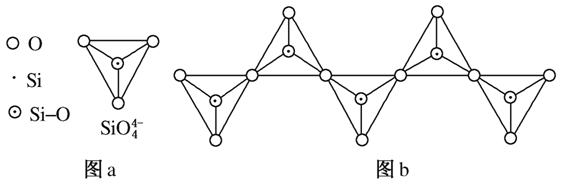
解析 (1)硅的基态原子中,能量最高的能层是第三电子层,符号为M,该能层有9个原子轨道,电子数为4。(2)硅还以SiO2形式存在于地壳中。(3)硅晶体中,硅原子间以共价键结合在一起,其晶胞6个面上各有一个硅原子,依据均摊原则,面心位置贡献3个原子。(4)可先写出:Mg2Si+NH4Cl―→SiH4,由原子守恒知还应该有MgCl2生成,配平镁、氯、硅元素后得Mg2Si+4NH4Cl―→SiH4+2MgCl2,再进一步分析知还应该有NH3生成,最终结果为Mg2Si+4NH4Cl===SiH4+2MgCl2+4NH3。(5)某类物质数量的多少与物质内化学键的稳定性强弱有关,由表中数据知C—C键、C—H键分别比Si—Si键、Si—H键稳定,故烷烃数量较多。同理因键能C—H>C—O、Si—O>Si—H,故SiH4的稳定性小于CH4,更易生成氧化物。(6)因硅与四个氧原子形成四个σ键,故硅原子为sp3杂化。在图a中,硅、氧原子数目比为14,但图b中每个硅氧四面体中有两个氧原子是与其他四面体共用的,故依据均摊原则可确定图b中硅、氧原子数目比为1:3,化学式为(SiO3)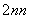 。
。
答案 (1)M 9 4
(2)二氧化硅
(3)共价键 3
(4)Mg2Si+4NH4Cl===SiH4+4NH3+2MgCl2
(5)①C—C键 和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
②C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(6)sp3 1:3 [SiO3]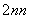 (或SiO
(或SiO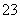 )
)


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、Na+ 、Cl-、SO42- B.Cu2+、Ca2+ 、CO32- 、Cl-
C.NH4+、 Ba2+ 、NO3-、HCO3- D.K+ 、Fe3+、Cl- 、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g) ΔH=-a kJ·mol-1
已知:
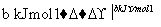

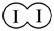
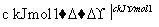
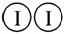 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO )=
)= 0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后
0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后 ,两极均收集到1.12 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
,两极均收集到1.12 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Na+)=0.2 mol·L-1
B.电解后溶液中c(H+)=0.2 mol·L-1
C.上述电解过程中共转移0.4 mol电子
D.电解后得到的Cu的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回 答相关问题:
答相关问题:
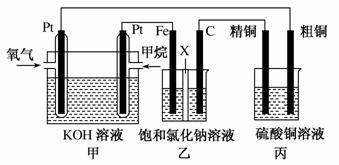
(1)甲烷燃料电池负极反应式是______________________ __________________________________________________。
(2)石墨(C)极的电极反应式为________________ __________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L;丙装置中阴极析出铜的质量为________g。
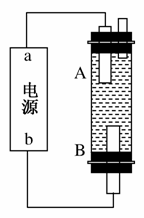
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的____极,电解质溶液最好用______。
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图a所示。
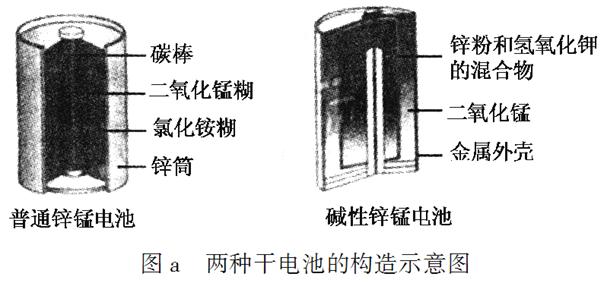
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是__________________________________________________________。
(2)图b表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

①图b中产物的化学式分别为A________,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为________________________________________。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO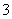 的物质的量为
的物质的量为 mol
mol
③反应过程中转移的电子数为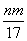 mol
mol
④标准状况下生成NO的体积为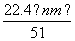 L
L
⑤与合金反应的硝酸的物质的量为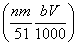 mol
mol
A.5项 B.4项
C.3项 D.2项
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组实验:①除去混在植物油中的水;②回收碘的CCl4溶液中的CCl4;③用食用酒精浸泡中草药提取其中的有效成分。以上实验采用的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com