
| A. | 某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X2+ | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 标况下22.4LC2H2中所含的π键数和18g冰中所含的氢键数均为2mol | |
| D. | PCl5和AlCl3形成的加合物PCl5•AlCl3由[PCl4]+和[AlCl4]-构成,化合物中的阴阳离子均为正四面体构型 |
分析 A.该元素第三电离能剧增,最外层应有2个电子,表现+2价;
B.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键;
C.乙炔的结构简式为H-C≡C-H,1mol乙炔中含2molπ键;1mol冰中存在2mol氢键;
D.计算价层电子对,再判断构型.
解答 解:A.该元素第三电离能剧增,最外层应有2个电子,表现+2价,当它与氯气反应时最可能生成的阳离子是X2+,故A正确;
B.在[Cu(NH3)4]2+离子中,铜离子含有空轨道,氨气分子含有孤电子对,所以Cu2+提供空轨道,NH3给出孤电子对,故B错误;
C.乙炔的结构简式为H-C≡C-H,则1mol乙炔中含2molπ键,
冰中水分子的O原子以类似于金刚石中C原子的四面体空间网状结构排列,每2个O原子间都有一个H原子,更靠近H原子的O原子与它形成共价键,另一个与它形成氢键,即每个H原子都形成一个氢键,所以1mol冰中存在2mol氢键,
标况下22.4LC2H2的物质的量为1mol,18g冰的物质的量也为1mol,则标况下22.4LC2H2中所含的π键数和18g冰中所含的氢键数均为2mol,故C正确;
D.[PCl4]+离子中P原子孤电子对数为$\frac{5-1-1×4}{2}$=0,价层电子对数为4+0=4,为正四面体构型,[AlCl4]-离子中Al原子孤电子对数为$\frac{3+1-1×4}{2}$=0,价层电子对数为4+0=4,为正四面体构型,故D正确;
故选B.
点评 本题考查物质结构与性质,涉及电离能、配合物、化学键、微粒空间结构等知识,难度中等,注意价层电子对公式的运用.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④>⑤ | B. | ②>①>⑤>④>③ | C. | ③>④>⑤>①>② | D. | ⑤>④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
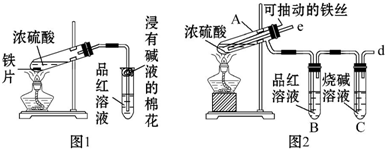
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解MgCl2 溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol | |
| C. | 将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-═Al2S3↓ | |
| D. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
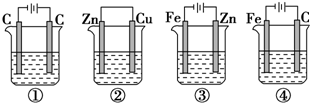
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为:
;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为: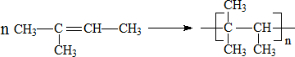 .
.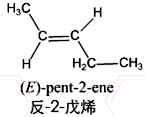 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 应密封保存 | |
| B. | 完全燃烧的反应属于复分解反应 | |
| C. | 可用作燃料 | |
| D. | 其中氮元素与氢元素的质量比为14:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的醋酸加水稀释过程中,所有离子浓度都降低 | |
| B. | 电解质在某种状态时可能不导电,非电解质自身一定不导电 | |
| C. | 强电解质溶液中一定不存在电离平衡 | |
| D. | 改变条件使电离平衡正向移动,溶液的导电能力一定增强,电离程度一定增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com