
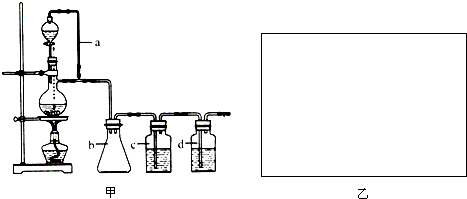
| 浓H2SO4 |
| △ |
 .
.


科目:高中化学 来源: 题型:
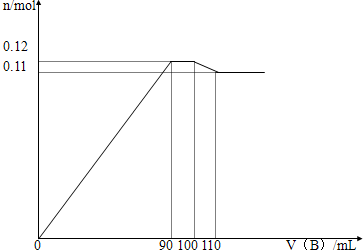
| 溶质 | c/mol?L-1 |
| Na2SO4 | |
| NaOH | |
| BaCl2 | |
| AlCl3 | |
| FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应容器 | 甲 | 乙 | 丙 |
| 加入合金质量(g) | 0.510 | 1.53 | 3.57 |
| 与盐酸反应生成气体(L) 与氢氧化钠反应产生气体(L) | 0.560 0.336 | 0.672 x | 0.672 y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
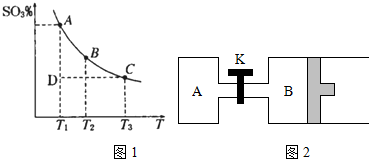
查看答案和解析>>
科目:高中化学 来源: 题型:

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 20. | 2.1 |
| 钒沉淀率(%) | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com