
| A. | 蔗糖的水解(试管、蔗糖溶液、新制的Cu(OH)2悬浊液) | |
| B. | 用NaOH标准溶液确定未知浓度的硫酸溶液(石蕊试液、碱式滴定管、锥形瓶) | |
| C. | 证明海带中存在碘元素(漏斗、稀硫酸、氯气、玻璃棒) | |
| D. | 制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |
分析 A.蔗糖溶液在酸性条件下水解,需要加热,可用试管直接加热;
B.选用酚酞作指示剂,不用石蕊试液;
C.若用氯气,则无需使用稀硫酸;
D.不用氢氧化钠溶液.
解答 解:A.蔗糖溶液在酸性条件下水解,需要加热,可用试管直接加热,水解后,用新制的Cu(OH)2悬浊液检验水解的产物,故A正确;
B.用NaOH标准溶液确定未知浓度的硫酸溶液选用酚酞作指示剂,不用石蕊试液,故B错误;
C.海带灰中含有碘离子,稀硫酸、3%的H2O2溶液能将碘离子氧化为碘单质,碘单质遇淀粉溶液变蓝色,可证明海带灰中含有碘元素,若用氯气,则无需使用稀硫酸,故C错误;
D.制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液,不用氢氧化钠溶液,故D错误.
故选A.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某特定反应的平衡常数只与温度有关 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 平衡常数发生改变,化学平衡必发生改变 | |
| D. | 化学平衡移动时,平衡常数必改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
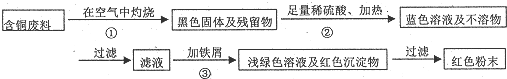
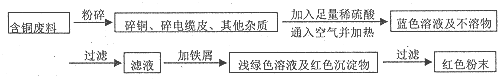
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH-)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若NO2与O2的体积比是4:3,则此溶液除了硝酸不含其他杂质 | |
| B. | 将一定量的Cu投入溶液中,只产生1.12L(标况)的红棕色气体,则反应的铜有1.6g | |
| C. | 将溶液在强光下光照,产生气泡,溶液变浅黄,产生气泡,则气泡是NO2 | |
| D. | 向浅黄的硝酸中通入氧气,可以使其pH值降低,溶液质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2C2O4溶液中,c(NH4+)=2c(C2O42-) | |
| B. | 等物质的量浓度的氨水和H2C204溶液等体积混合,所得溶液呈碱性 | |
| C. | pH=11的氨水和pH=3的H2C204溶液等体积混合,所得溶液呈酸性 | |
| D. | 用H2C204溶液中和氨水至中性时,溶液中c(NH4+)=2c(C2O42-)+c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
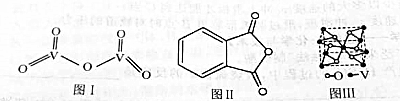
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{175}{176}$ | B. | $\frac{100}{99}$ | C. | $\frac{99}{100}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com