
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫__________________
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2L。则:CO2和CO的体积之比是_____________
(5)在标准状况下,将224 L HCl气体溶于635 mL水(水的密度看作1g/mL)中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度是___________
【答案】丁达尔效应 95g/mol N2或者 CO或C2H4 1∶7 11.8 mol·L-1
【解析】
(1)光束通过胶体时,产生光亮的通路,称为丁达尔效应;
(2)先根据二价金属A的氯化物的分子式,由Cl-的物质的量求出氯化物的物质的量,再根据公式M=![]() 来确定摩尔质量;
来确定摩尔质量;
(3)依据n=![]() ,n=
,n=![]() 计算摩尔质量分析判断气体;
计算摩尔质量分析判断气体;
(4)在标准状况下,15gCO和CO2的混合气体的体积为11.2L,物质的量为0.5mol,令一氧化碳的物质的量为xmol,二氧化碳的物质的量为ymol,列方程计算x、y的值,在根据N=nNA计算CO和CO2的分子数之比,进行判断;
(5)根据n=![]() 计算224LHCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据ω(HCl)=
计算224LHCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据ω(HCl)=![]() ×100%计算盐酸的质量分数,再根据c=
×100%计算盐酸的质量分数,再根据c=![]() 计算盐酸的物质的量浓度。
计算盐酸的物质的量浓度。
(1)光束通过胶体时,产生光亮的通路,称为丁达尔效应,是胶体的特征性质,故答案为:丁达尔效应;
(2)因某二价金属的氯化物ACl2中含有0.4molCl可知,氯化物ACl2的物质的量为![]() =0.2mol,则M(ACl2)=
=0.2mol,则M(ACl2)= ![]() =
=![]() =95g/mol,故答案为:95g/mol;
=95g/mol,故答案为:95g/mol;
(3)在标准状况下,测得4.2g气体A的体积是3360mL,M=![]() =
= =28g/mol,则气体可能为N2或者CO或C2H4,故答案为:N2或者CO或C2H4;
=28g/mol,则气体可能为N2或者CO或C2H4,故答案为:N2或者CO或C2H4;
(4)在标准状况下,15gCO和CO2的混合气体的体积为11.2L,物质的量为0.5mol,令一氧化碳的物质的量为xmol,二氧化碳的物质的量为ymol,则xmol+ymol=0.5mol,xmol×28g/mol+ymol×44g/mol=15g,解得x=716,y=116,则CO2和CO的体积之比是1:7,故答案为:1:7;
(5)标准状况下,224LHCl气体的物质的量为![]() =10mol,故HCl的质量为10mol×36.5g/mol=365g,635mL水的质量为635mL×1g/mL=635g,故HCl的质量分数为
=10mol,故HCl的质量为10mol×36.5g/mol=365g,635mL水的质量为635mL×1g/mL=635g,故HCl的质量分数为![]() ×100%=36.5%,所得盐酸的物质的量浓度为
×100%=36.5%,所得盐酸的物质的量浓度为![]() =
=![]() mol/L=11.8mol/L,故答案为:11.8mol/L。
mol/L=11.8mol/L,故答案为:11.8mol/L。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将①50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________。
(2) 若将盐酸换成同浓度和同体积的醋酸,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用40 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上
述实验相比,所放出的热量_________(填“比①大”、 “比①小”或“相等”),理由是_____________________________________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[![]() ]和水碳比[
]和水碳比[![]() ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为____。
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由_____。
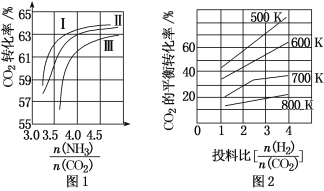
(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
①该反应的化学平衡常数的表达式为_____。
②该反应的ΔS___0,ΔH___0(填“>”或“<”)。
③700K投料比[![]() ]=2时,H2的平衡转化率为_____。
]=2时,H2的平衡转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L1的NaOH溶液分别滴定均为20.00mL0.100mol·L1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
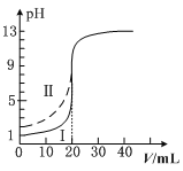
A.Ⅰ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 氢键 E 范德华力
(4)SF6被广泛用作高压电气设备绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系的键能。则S—F的键能为_______kJ·mol-1。

(5)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是_____________;
② 已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=__________nm (列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.l mol/ L RCOOH溶液的pH, 溶液中 RCOOH、RCOO- 的微粒分布分数![]() 也随之改变,甲酸( HCOOH) 与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示.
也随之改变,甲酸( HCOOH) 与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示.

下列说法正确的是
A.丙酸的酸性比甲酸强
B.若0.1 mol/甲酸溶液的pH=2.33.则0.0lmol/L甲酸溶液的pH=3.33
C.将0.1mol/L的HCOOH溶液与0. 1 mol/L的HCOONa溶液等体积混合,所得溶液中:c( Na+ ) >c( H COO H ) >c( H COO- ) >c( OH-) >c ( H + )
D.CH3CH2COOHCH3CH2COO- +H+ lgK=-4 .88
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K__________1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向_____________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_______________。
Ⅱ.在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:2A(g)+B(g)![]() 3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(3)达到平衡时,C在反应混合气体中的体积分数是___(用含a的代数式表示)。
(4)在相同的实验条件下,若在同一容器中改为加入2 mol A和4 mol B,达到平衡后,C的物质的量为___mol(用含a的代数式表示)。此时C在反应混合气体中的体积分数与原平衡相比___(填“增大”“减小”或“不变”)。
(5)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气体中的体积分数仍与原平衡相同,则还应加入___mol C。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
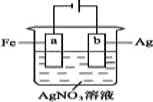

①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A. ①③B. ③④C. ①②④D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com