
分析 (1)Cu原子价电子排布式为3d104s1,失去4s能级的1个电子形成Cu+;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于同周期相邻元素的,稀有气体的第一电离能最大;
原子数目相等、价电子总数也相等的微粒互为等电子体,分子中正负电荷重心重合的分子属于非极性分子(中心原子价电子全部成键);
(3)Se的原子半径大于S的,故H-Se不如H-S键稳定;
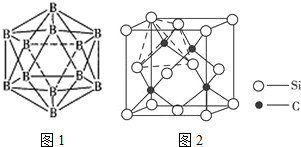
(4)两个10B有3位置,为图中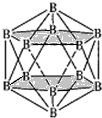 上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点;
上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点;
(5)①三个碳原子和三个硅原子相间构成一个六元环为图中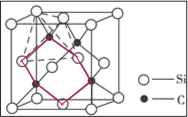 红线连接的原子,为椅式结构;
红线连接的原子,为椅式结构;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子;
③黑色球连接周围的4个白色球形成正四面体结构,黑色球位于正四面体的中心,黑色球与晶胞顶点白色球连线处于晶胞体对角线上,且二者之间距离为体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,据此算晶胞棱长,根据均摊法计算晶胞中Si、C原子数目,表示出晶胞的质量,再根据ρ=$\frac{m}{V}$计算晶体密度;
Si、C原子之间形成共价键,原子间距小于二者原子半径之和,计算的体积比实际体积偏大;
(6)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H20的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界;
(7)分解生成金属氧化物,金属氧化物的晶格能大,更稳定,更易于生成.
解答 解:(1)Cu原子价电子排布式为3d104s1,失去4s能级的1个电子形成Cu+,Cu+基态时的价电子排布式为3d10,
故答案为:3d10;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于同周期相邻元素的,稀有气体的第一电离能最大,故第二周期第一电离能:Ne>F>N>O>C>Be>B>Li,
原子数目相等、价电子总数也相等的微粒互为等电子体,与NO3-互为等电子体的一种非极性分子化为SO3等,
故答案为:3;SO3等;
(3)Se的原子半径大于S的,故H-Se不如H-S键稳定,在溶液中更溶液电离,故H2Se的酸性比H2S强,
故答案为:强;
(4)两个10B有3位置,为图中 上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点,有3种结构,
上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点,有3种结构,
故答案为:3;
(5)①三个碳原子和三个硅原子相间构成一个六元环为图中 红线连接的原子,为椅式结构,
红线连接的原子,为椅式结构,
故答案为:椅;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,则与硅原子次近的第二层有12个原子,
故答案为:12;
③黑色球连接周围的4个白色球形成正四面体结构,黑色球位于正四面体的中心,黑色球与晶胞顶点白色球连线处于晶胞体对角线上,且二者之间距离为体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,故晶胞棱长为(a×10-8cm+b×10-8cm)×4÷$\sqrt{3}$,晶胞中C原子数目为4,Si原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为4×$\frac{12+28}{{N}_{A}}$g,故晶体密度为4×$\frac{12+28}{{N}_{A}}$g÷[(a×10-8cm+b×10-8cm)×4÷$\sqrt{3}$]3=$\frac{160}{{N}_{A}×[\frac{4(a+b)}{\sqrt{3}}×1{0}^{-8}]^{3}}$g/cm3,
密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切,碳、硅原子间的距离比两个原子半径之和小,
故答案为:$\frac{160}{{N}_{A}×[\frac{4(a+b)}{\sqrt{3}}×1{0}^{-8}]^{3}}$;密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切,碳、硅原子间的距离比两个原子半径之和小;
(6)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H20的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+,
故答案为:[TiCl(H2O)5]2+;
(7)碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果,产物中氧化镁和氧化钙都为离子晶体,因为镁离子半径小于钙离子半径则氧化镁晶格能大,更稳定,更易于生成,稳定性:CaCO3>MgCO3,
故答案为:稳定性:CaCO3>MgCO3,碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果,产物中氧化镁和氧化钙都为离子晶体,因为镁离子半径小于钙离子半径则氧化镁晶格能大,更稳定,更易于生成.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、等电子体、晶胞计算与计算、配合物、晶格能等,是对学生综合能力的考查,难度较大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | 最高价氧化物对应水化物的酸性:Y>W | |
| D. | Z、W均可与Mg形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 根据原子核外电子排布的特点,Zn在周期表中属于ds区元素 | |
| B. | P4和CH4都是正四面体形分子且键角都为109°28′ | |
| C. | NH3分子中N原子和H2O分子中O原子的杂化类型不相同 | |
| D. | 原子间只通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
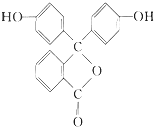
| A. | 酚酞具有弱酸性,且属于芳香烃 | |
| B. | 酚酞的分子式为C19H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 0.1 mol/L的氨水中加少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 常温下,0.1 mol/L一元酸(HA)溶液的 pH=3,则该溶液中,c2(H+)=c(H+)×c(A-)+Kw | |
| C. | 向含有 1 mol KAl(SO4)2 的溶液中加入 Ba(OH)2 溶液得到沉淀的物质的量最多为 2 mol | |
| D. | 将 Ca(ClO)2、Na2SO3、FeCl3、NaAlO2 溶液蒸干均得不到原溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
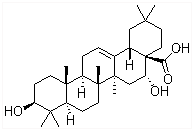 刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )
刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )| A. | 和氧所催化氧化后产物中含有醛基 | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生取代、氧化、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
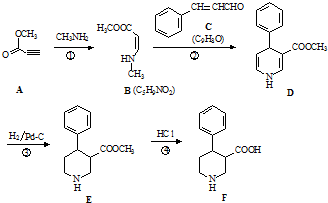
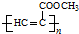 .
.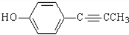 .
.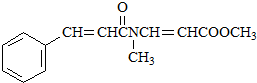 .
.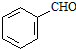 、CH3CH2OH和
、CH3CH2OH和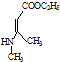 为原料,合成
为原料,合成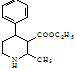 ,写出合成流程图(无机试剂任用).
,写出合成流程图(无机试剂任用).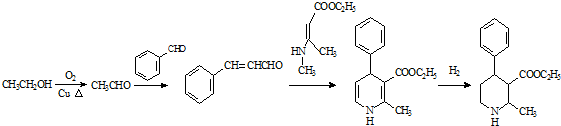
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ•mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
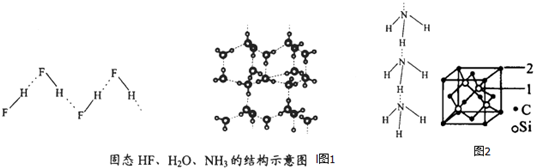
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com