
| A. | CH4和C3H6 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | CH4和C2H4 |
分析 8.8gCO2的物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,3.6g水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,根据原子守恒,则混合气体的平均分子式为C2H4,结合平均C、H原子数目进行判断.
解答 解:8.8gCO2的物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,3.6g水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,根据原子守恒,则混合气体的平均分子式为C2H4,
A.CH4和C3H6按物质的量1:1混合,平均分子式为C2H5,故A错误;
B.C2H4和C2H6按物质的量1:1混合,平均分子式为C2H5,故B错误;
C.CH4和C3H4按物质的量1:1混合,平均分子式为C2H4,故C正确;
D.CH4和C2H4平均碳原子数目小于2,故D错误,
故选C.
点评 本题考查了有机物分子式的计算,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,常用方法有:平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同素异形体 | B. | H、D、T互为同位素 | ||
| C. | CH3-CH3与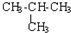 互为同系物 互为同系物 | D. | 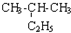 与 与 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| C. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| D. | 为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积:④<①<③<② | B. | 质量:④<①<③<② | ||
| C. | 物质的量:①<②<③<④ | D. | 氢原子数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com