
| A. | NaOH═Na++O2-+H+ | B. | MgCl2═Mg2++Cl22- | ||
| C. | KClO3═K++Cl-+3O2- | D. | NH4NO3═NH4++NO3- |
分析 A.NaOH是强电解质,在水溶液中完全电离生成钠离子和氢氧根离子;
B.氯化镁是强电解质,在水溶液中完全电离生成镁离子和2个氯离子;
C.氯酸钾是强电解质,在水溶液中完全电离生成钾离子和氯酸根离子,氯酸根离子是原子团不能拆开;
D.硝酸铵是强电解质,在水溶液中完全电离生成铵根离子和硝酸根离子.
解答 解:A.NaOH是强电解质,在水溶液中完全电离生成钠离子和氢氧根离子,电离方程式为NaOH═Na++OH-,故A错误;
B.氯化镁是强电解质,在水溶液中完全电离生成镁离子和2个氯离子,电离方程式为MgCl2═Mg2++2Cl2-,故B错误;
C.氯酸钾是强电解质,在水溶液中完全电离生成钾离子和氯酸根离子,氯酸根离子是原子团不能拆开,电离方程式为KClO3═K++ClO3-,故C错误;
D.硝酸铵是强电解质,在水溶液中完全电离生成铵根离子和硝酸根离子,电离方程式为NH4NO3═NH4++NO3-,故D正确;
故选D.
点评 本题考查电离方程式书写,电离方程式书写时原子团不能拆开,要注意电荷与化合价表示方法的区别,题目难度不大.


科目:高中化学 来源: 题型:填空题
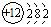 ,O2-结构示意图:
,O2-结构示意图: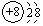 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 | B. | 摩尔质量 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式相同的不同物质一定属于同系物 | |
| B. | 完全燃烧某有机物,生成CO2和H2O的物质的量之比为1:1,该有机物只可能是烯烃或环烷烃 | |
| C. | 分子式相同而结构不同的化合物一定互为同分异构体 | |
| D. | 符合通式CnH2n-2的有机物一定是炔烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②⑤①③④ | C. | ①③⑤②④ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
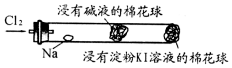 某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃| A. | 钠着火燃烧产生苍白色火焰和白烟 | |
| B. | 白烟是氯化钠微晶分散在空气中形成 | |
| C. | 玻管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境 | |
| D. | 根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
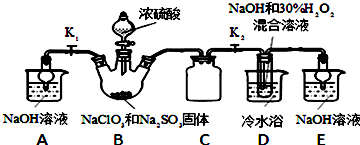
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
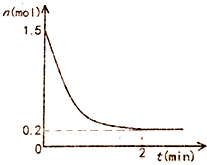 在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:
在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com