
| A. | 若x=y,且a+b=14,则pH>7 | B. | 若10x=y,且a+b=13,则pH=7 | ||
| C. | 若ax=by,且a+b=14,则pH=7 | D. | 若x=10y,且a+b=14,则pH>7 |
分析 常温下pH=b的稀NaOH溶液中c(OH-)=10b-14mol/L,pH=a的稀盐酸中c(H+)=10-amol/L,则:$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$,若二者恰好中和,应存在10b-14y=10-ax,pH=7,若10b-14y>10-ax,碱过量,溶液pH>7,若10b-14y<10-ax,酸过量,溶液的pH<7,以此解答该题.
解答 解:常温下pH=b的稀NaOH溶液中c(OH-)=10b-14mol/L,pH=a的稀盐酸中c(H+)=10-amol/L,则
A.若x=y,且a+b=14,则$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-14=1,即n(H+)=n(OH-),酸碱恰好中和,溶液呈中性,pH=7,故A错误;
B.若10x=y,且a+b=13,则$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-13=1,即n(H+)=n(OH-),酸碱恰好中和,反应后溶液的pH=7,故B正确;
C.若ax=by,且a+b=14,则$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-14×$\frac{y}{x}$=$\frac{b}{a}$,因a<b,则碱过量,pH>7,故C错误;
D.若x=10y,且a+b=14,则$\frac{n(O{H}^{-})}{n({H}^{+})}$=$\frac{1{0}^{b-14}y}{1{0}^{-a}x}$=10a+b-15=0.1,则酸过量,溶液的pH<7,故D错误;
故选B.
点评 本题考查酸碱混合的计算和判断,题目难度中等,注意根据体积和pH的关系确定酸碱溶液中$\frac{n(O{H}^{-})}{n({H}^{+})}$的值,以此确定反应的程度,试题充分考查了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,熵增加的反应一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程只与焓变有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
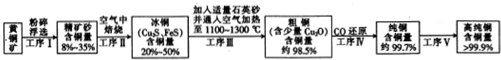
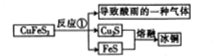
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4具有强氧化性,可用作水处理剂 | |
| B. | 氢氧化铝具有弱碱性,可用作制胃酸中和剂 | |
| C. | 碳具有还原性,可用作锌锰干电池的正极材料 | |
| D. | 常温下浓硫酸能使铝发生钝化,可用铝制容器贮运浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3a+b) mol | B. | (3a+0.5b-3.5c) mol | ||
| C. | ( 3a+b+3.5c) mol | D. | (3a+0.5b) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
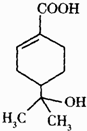 某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是( )
某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是( )| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | 全部不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 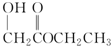 | B. | 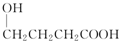 | C. | 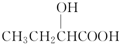 | D. | 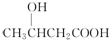 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com