
| A. | 为了减慢反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 为了除去杂质气体,可用硫酸铜溶液 | |
| D. | 反应中需加碎瓷片作沸石 |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2 H2O | |
| B. | 碳酸钠溶液与醋酸反应 CO32-+2H+=CO2↑+H2O | |
| C. | Ca (ClO)2溶液中通入过量的二氧化硫气体 ClO-+H2O+SO2=HSO3-+HClO | |
| D. | 硫化氢气体通入硫酸铁溶液中:H2S+2Fe3+=2Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

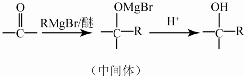
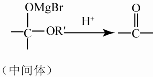
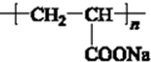

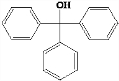 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
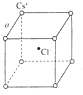 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}{a}^{3}}$g•cm-3 | B. | $\frac{M{a}^{3}}{{8N}_{A}}$g•cm-3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g•cm-3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
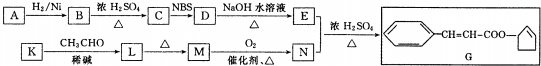
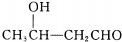
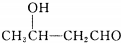 $\stackrel{△}{→}$CH3CH=CHCHO+H2O
$\stackrel{△}{→}$CH3CH=CHCHO+H2O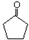 ,G中官能团的名称为碳碳双键、酯基.
,G中官能团的名称为碳碳双键、酯基.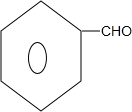 +CH3CH2OH$\stackrel{稀碱}{→}$
+CH3CH2OH$\stackrel{稀碱}{→}$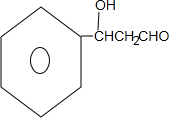 ,反应类型加成反应.
,反应类型加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com