
 (各2分,过程2分)
(各2分,过程2分)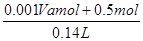 =
=


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:不详 题型:填空题
 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
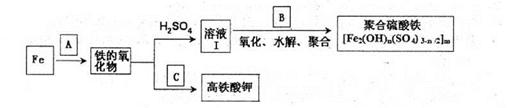


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
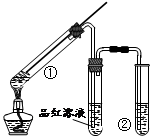
| A.浓硫酸既表现了强氧化性,又表现了酸性 |
| B.品红溶液的作用是吸收SO2,防止空气污染 |
| C.该实验体现环境保护和节约化学试剂的理念 |
| D.装置②中盛放的试剂可能NaOH是溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于50 mL | B.大于50 mL | C.等于100 mL | D.大于100 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.4g | B.3.2g | C.6.4g | D.9.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.滤液A中的阳离子为Fe2+、Fe3+、H+ | B.V=224 |
| C.样品中CuO的质量为4.0g | D.V=448 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com