
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;常温下H2C2O4为晶体,易溶于水,溶解度随温度升高而增大。

请回答:
(1)步骤②,发生反应的离子方程式____________________________;该步骤H2C2O4稍过量主要是为了_________________。
(2)下列操作或描述正确的是_______________。
A.步骤①,酸化主要是为了抑制Fe2+水解
B.步骤③,如果采用冷水洗涤可提高除杂效果
C.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n(C2O42-)·mol-1 | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.98 |
由表中数据推测试样中最主要的杂质是_________________。
(4)实现步骤④必须用到的两种仪器是_________(供选仪器如下)
a.坩埚;b.烧杯;c.蒸馏烧瓶;d.锥形瓶;e.表面皿:f.高温炉
该步骤的化学方程式是______________________________________________。
【答案】Fe2+ + H2C2O4 + 2H2O = FeC2O4·2H2O +2H+ 将溶液里的Fe2+完全转化为草酸亚铁晶体,提高原料利用率 AC (NH4)2SO4 af 4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O
2Fe2O3+8CO2+8H2O
【解析】
(1)步骤②是Fe2+与草酸反应生成FeC2O4·2H2O晶体的反应;从提高产率的角度分析;
(2)A. Fe2+水解使溶液显酸性;
B.H2C2O4易溶于水,溶解度随温度的升高而增大;
C. FeC2O4·2H2O难溶于水,150℃开始失结晶水;
(3)溶液中c(Fe2+)和c(C2O42-)之间满足电荷守恒,杂质中不存在Fe2+和C2O42-;
(4)灼烧固体在坩埚中进行;FeC2O4在空气中灼烧生成Fe2O3和CO2,根据电子守恒和原子守恒书写方程式。
(1)硫酸亚铁铵晶体溶于水,为了防止Fe2+的水解,在溶液中加入酸可抑制其水解,加入过量的草酸,可将Fe2+完全转化为FeC2O4·2H2O,反应的离子方程式为:Fe2++H2C2O4+ 2H2O = FeC2O4·2H2O+2H+;为了将Fe2+完全沉淀,将溶液里的Fe2+完全转化为FeC2O4·2H2O,提高产率,所以草酸要过量;
(2)A. Fe2+水解使溶液显酸性,在溶液中加入酸可抑制Fe2+水解,使水解平衡逆向移动,A项正确;
B. H2C2O4易溶于水,溶解度随温度的升高而增大,因此采用热水洗涤可提高草酸的溶解度,提升除杂效果,B项错误;
C. FeC2O4·2H2O难溶于水,150℃开始失结晶水,因此如果在常压下快速干燥,温度可选择略高于100℃,但要低于150℃,C项正确;
答案选AC;
(3)由表中数据可知,溶液中c(Fe2+)和c(C2O42-)之间满足电荷守恒,杂质中不存在Fe2+和C2O42-,因此杂质为反应的另一产物(NH4)2SO4;
(4)灼烧固体在坩埚中进行,因此选用的仪器有坩埚和加热所需的高温炉;FeC2O4在空气中灼烧生成Fe2O3和CO2,反应方程式为:4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O。
2Fe2O3+8CO2+8H2O。


科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
B.H2O(g)===H2(g)+1/2O2(g) ΔH=+242 kJ·mol-1
C.H2(g)+1/2O2(g)===H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)常温时,FeCl3 溶液的pH___7(填“>”、“<”或“=”),原因是(用离子方程式表示________)
(2)常温时,Na2CO3溶液的pH____7(填“>”、“<”或“=”),原因是(用离子方程式表示______)
(3)用石墨作电极电解AgNO3溶液,电解一段时间后溶液的酸性_____(填“增强”、或“减弱”),阳极产物是_______,阴极产物是______,电解反应的总方程式为________;
(4)用石墨作阳极,铁作阴极电解Na2SO4溶液,电解一段时间后溶液的酸性_____(填“增强”、“减弱”或“不变”),阳极产物是_______,阴极产物是______,电解反应的总方程式为__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.14g乙烯、丙烯、丁烯的混合气体中所含原子数为3NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2L氯仿所含分子数为0.5NA
D.32g甲醇中含有C—H键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上
用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上![]() 的制备路线如图:
的制备路线如图:
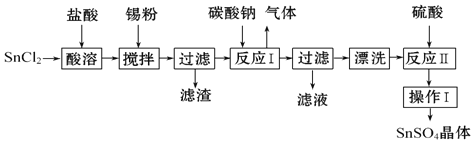
已知:
Ⅰ![]() 酸性条件下,锡在水溶液中有
酸性条件下,锡在水溶液中有![]() 、
、![]() 两种主要存在形式,
两种主要存在形式,![]() 易被氧化.
易被氧化.
Ⅱ![]() 易水解生成碱式氯化亚锡.
易水解生成碱式氯化亚锡.
回答下列问题:
![]() 锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是______.
锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是______.
![]() 操作Ⅰ是______、______、过滤、洗涤.
操作Ⅰ是______、______、过滤、洗涤.
![]() 粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因:______.
粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因:______.
![]() 加入锡粉的作用有两个:
加入锡粉的作用有两个:![]() 调节溶液pH,
调节溶液pH,![]() ______.
______.
![]() 反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______.
反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______.
![]() 酸性条件下,
酸性条件下,![]() 还可以用作双氧水去除剂,发生反应的离子方程式是______.
还可以用作双氧水去除剂,发生反应的离子方程式是______.
![]() 该小组通过下列方法测定所用锡粉的纯度
该小组通过下列方法测定所用锡粉的纯度![]() 杂质不参与反应
杂质不参与反应![]() :
:
![]() 将试样溶于盐酸中,反应为
将试样溶于盐酸中,反应为![]() ;
;
![]() 加过量
加过量![]() 氧化
氧化![]() 生成
生成![]() ;
;
![]() 用已知浓度的盐酸酸化过的
用已知浓度的盐酸酸化过的![]() 滴定生成的
滴定生成的![]() ,反应的化学方程是:
,反应的化学方程是:![]()
取![]() 锡粉,经上述各步反应后,共用去
锡粉,经上述各步反应后,共用去![]() 溶液
溶液![]() ,则锡粉中锡的质量分数是______。保留一位小数
,则锡粉中锡的质量分数是______。保留一位小数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①甲烷、②乙烷、③丙烷、④丁烷4种烷烃,试回答下列各题(填序号):
a.上述气态烃中,其一氯取代物的同分异构体只有两种的是___。
b.等物质的量上述气态烃充分燃烧,消耗O2的量最多的是___。
c.等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是__。
(2)有4种无色液态物质: a.1-庚烯[CH3(CH2)4CH=CH2]、b.戊烷[ CH3(CH2)3CH3]、c.苯(![]() )、d.甲苯(
)、d.甲苯(![]() ),
),
请回答下列问题:
①能与溴水和酸性KMnO4溶液反应的是__(写编号),
②不能与溴水反应但能与酸性KMnO4溶液反应的是___(写编号)。
③不能与溴水和酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是___(写编号),反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 氯丙酸
氯丙酸![]() 主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备
主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备![]() 氯丙酸的装置。
氯丙酸的装置。
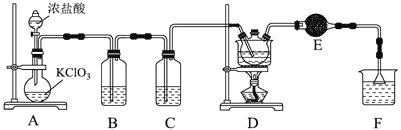
已知:相关物质的物理性质如下表所示:
物质 | 熔点 | 沸点 | 溶解性 |
| 14 | 190 | 能与水、乙醇互溶 |
丙酸 |
| 141 | 能与水、乙醇互溶 |
|
|
| 与水剧烈反应,能溶于乙醇 |
制备方法:在三颈烧瓶中放置![]() 丙酸和
丙酸和![]() 三氯化磷
三氯化磷![]() 作催化剂
作催化剂![]() ,加热至
,加热至![]() ,缓慢通入氯气,保持温度在
,缓慢通入氯气,保持温度在![]() 之间大约反应
之间大约反应![]() 。
。
回答下列问题:
![]() 装置中反应的离子方程式为_____________________________________________,当生成
装置中反应的离子方程式为_____________________________________________,当生成![]() (标准状况)时,转移电子的数目为________________。
(标准状况)时,转移电子的数目为________________。
![]() 某同学分析发现D装置有两处缺陷,分别是_____________、________________。
某同学分析发现D装置有两处缺陷,分别是_____________、________________。
![]() 设计实验提纯产品:_________________________________________________________。
设计实验提纯产品:_________________________________________________________。
![]() 测定产品纯度。
测定产品纯度。
步骤Ⅰ:称取1.20g样品![]() 杂质不含
杂质不含![]() 于烧瓶中,加入
于烧瓶中,加入![]() 氢氧化钠溶液共热,冷却至室温。加入
氢氧化钠溶液共热,冷却至室温。加入![]() 硝酸,一段时间后,将烧瓶中的溶液全部转移至
硝酸,一段时间后,将烧瓶中的溶液全部转移至![]() 容量瓶中,加水定容
容量瓶中,加水定容![]() 溶液中为乳酸和
溶液中为乳酸和![]() 。
。
步骤Ⅱ:从容量瓶中各取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 作指示剂,用
作指示剂,用![]() 溶液分别滴定溶液中的
溶液分别滴定溶液中的![]() 已知:
已知:![]() 为砖红色沉淀、乳酸银不沉淀
为砖红色沉淀、乳酸银不沉淀![]() ,平行三次实验,所得滴定数据如表所示:
,平行三次实验,所得滴定数据如表所示:
实验序号 实验数据 | 第一次 | 第二次 | 第三次 | |
| 滴定前 | 0 |
|
|
滴定后 |
|
|
| |
![]() 加入硝酸的目的是_______________________________________。
加入硝酸的目的是_______________________________________。
![]() 步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
![]() 样品中
样品中![]() 氯丙酸的质量分数为__________
氯丙酸的质量分数为__________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由实验得出的结论正确的是( )
选项 | 实验操作及现象 | 结论 |
A | 甲烷与氯气以体枳比1:1混合在光照下反应生成油状物质 | 油状物质为一氯甲烷 |
B | 将苯加入溴水中,振荡,溴水层为无色 | 苯与Br2发生了加成反应 |
C | 碳酸钠溶液中加入乙酸产生气泡 | 乙酸酸性强于碳酸 |
D | 加热乙醇、冰醋酸及浓硫酸的混合液,有果香味物质生成 | 乙醇与冰醋酸发生了加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图像所得结论正确的是

A.图甲是反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0中SO2的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且Y1>Y2
2SO3(g) ΔH<0中SO2的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且Y1>Y2
B.图乙是室温下用0.1000 mol·L-1的一元酸HA滴定20.00 mL 0.1000 mol·L-1的一元碱BOH的滴定曲线,说明BOH是强碱
C.图丙是室温下稀释冰醋酸时溶液的导电能力随加入水的体积的变化曲线,说明醋酸的电离程度:b>a>c
D.图丁是室温下稀释相同体积、相同pH的稀盐酸和稀醋酸时溶液的pH随加入水的体积的变化曲线,说明曲线M代表的是盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com