
| 6.72L |
| 22.4L/mol |
| 6.72L |
| 22.4L/mol |
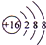 ,故答案为:
,故答案为: ;
;| 1 |
| 1 |
| 8 |
| 16 |
| ||
| ||


科目:高中化学 来源: 题型:
A、2Mg+O2
| ||||
| B、HCl+NaOH=NaCl+H2O | ||||
C、C+H2O
| ||||
| D、CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | ||
B、氢氧化钡溶液跟稀硫酸反应:Ba 2++OH-+H++S
| ||
| C、钠和水的反应:Na+H2O═2OH-+H2↑ | ||
D、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)2↓+3NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO4 |
| 第二次 | BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3 |
| 实验步骤 | 实验操作 | 实验目的 | 离子反应 |
| 第一步 | 向溶液中滴加过量的HNO3溶液 | 检验 |
|
| 第二步 | 继续滴加过量的Ba(NO3)2溶液 | 检验SO42-的存在 | |
| 第三步 | 过滤,再向滤液中滴加 |
检验 |
Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com