
| A. | 硫酸、纯碱、硫酸钙 | B. | 盐酸、苛性钠、硫酸亚铁 | ||
| C. | 碳酸、乙醇、烧碱 | D. | 磷酸、熟石灰、生石灰 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓ | |
| B. | CO32-+2H+═CO2↑+H2O NaHCO3+HCl═NaCl+CO2↑+H2O | |
| C. | H++OH-═H2O 2HCl+Mg(OH)2═MgCl2+2H2O | |
| D. | Ba2++SO42-═BaSO4↓ BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 品名 | 部分配料 |
| 菠萝汁 | ①浓缩菠萝汁 ②白砂糖 ③柠檬黄 ④山梨酸钾 |
| 火腿肠 | ⑤精选瘦肉 ⑥食盐 ⑦味精 ⑧亚硝酸钠 |
| 方便面 | ⑨小麦粉 ⑩牛肉⑪脱水菠菜⑫鸡蛋⑬姜黄⑭食用棕榈油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
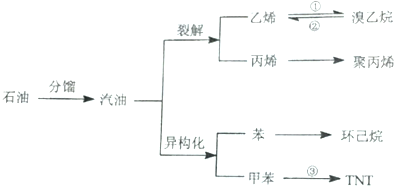
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 增大压强 | C. | 升高温度 | D. | 增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com