
如下图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述中正确的是 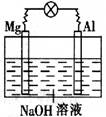
| A.镁比铝活泼,镁失去电子被氧化成Mg2+。 |
| B.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成 |
| C.该装置的内、外电路中,均是电子的定向移动形成电流 |
| D.该装置开始工作时,铝片表面的氧化膜可不必处理 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )。
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
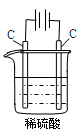
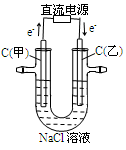
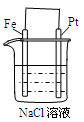
下列说法不正确的是
| A. | B. | C. | D. |
| 通电一段时间后,搅拌均匀,溶液的pH增大 | 甲电极上的电极反应为: 2Cl- -2e- = Cl2↑ | Pt电极上的电极反应为:O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于锌-铜-稀H2SO4组成的原电池装置中,当导线中有1mol电子通过时理论上的电极变化:
①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出了1g H2 ④铜片上析出1molH2
| A.①③ | B.①④ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有A、B、C、D四种金属片:
①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;
②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。
根据上述情况,下列说法中正确的是( )
A.在①中,金属片B发生还原反应
B.在②中,金属片C作正极
C.如果把B、D用导线连接后同时浸入稀硫酸中,则金属片D上有气泡产生
D.上述四种金属的活动性由强到弱的顺序是:A>B>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可直接把化学能转化为电能 |
| D.铅蓄电池充电时,阳极的反应为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲的质量减少;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
| A.甲>乙>丙>丁 | B.甲>丙>乙>丁 |
| C.甲>丙>丁>乙 | D.乙>丁>丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确是
| A.阳极反应为Fe-2e- =Fe2+ |
| B.电解过程中溶液pH不会变化 |
| C.过程中有Fe(OH)3沉淀生成 |
| D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com