
| A. | 3g ${\;}_{1}^{3}$H发生核反应:${\;}_{1}^{2}H$+${\;}_{1}^{3}H$→${\;}_{2}^{4}He$+${\;}_{0}^{1}n$,净产生的中子数为NA | |
| B. | 0.1L1mol/L盐酸含有的H+的数目为0.1NA | |
| C. | 标准状况下,22.4LCCl4含有的原子数目为5 NA | |
| D. | 1L0.4mol/L浓盐酸与足量的MnO2反应转移电子的物质的量为0.2 NA |
分析 A.核反应方程的质量数和电荷数守恒,12H+13H→24He+01n,反应可知净产生的中子数为NA ;
B.因素溶液中水电离出氢离子;
C.标准状况下四氯化碳不是气体;
D.浓盐酸和二氧化锰反应随反应进行变化为稀盐酸不与二氧化锰发生反应.
解答 解:A.3g ${\;}_{1}^{3}$H物质的量=$\frac{3g}{3g/mol}$=1mol,12H+13H→24He+01n,反应可知净产生的中子数为NA ,故A正确;
B.0.1L 1mol/L盐酸溶液中,水也会电离出氢离子,含有的H+的数目大于0.1NA ,故B错误;
C.标准状况下四氯化碳不是气体,22.4LCCl4含物质的量不是1mol,故C错误;
D.1L0.4mol/L浓盐酸与足量的MnO2反应,随反应进行,变化为稀盐酸不与二氧化锰反应,转移电子的物质的量小于0.2 NA ,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和微粒数计算、气体摩尔体积条件应用,注意浓盐酸和足量二氧化锰不能完全反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 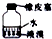 |
| 用Cl2氧化溶液中的Br- | 分离有机层和水层 | 高温结束后先 停止加热后停止通水 | 贮存液溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
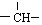 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯催化加氢后得到3,3-二甲基-丁烷 | |
| B. | 2-甲基-1,3-丁二烯与Br2的加成产物有3种 | |
| C. | 根据所有原子不在同一平面上可以说明C4H6的某烃是1-丁炔而不是CH2=CH-CH=CH2 | |
| D. | 已知具有单双键交替长链(如:-CH=CH-CH=CH-CH=CH-)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
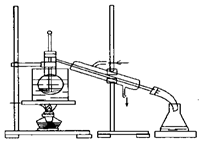
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀. | 酸性:H2CO3>H2SiO3 |
| D | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com