
 I��ijѧ���������ͼ1��ʾ��װ�ã����ڲ���δ����������װ������������ķ�ӦΪCu+H2SO4=H2��+CuSO4���Իش�
I��ijѧ���������ͼ1��ʾ��װ�ã����ڲ���δ����������װ������������ķ�ӦΪCu+H2SO4=H2��+CuSO4���Իش�
| ||
| ||
| 0.112L��2mol |
| 22.4L |
| 0.01mol |
| 0.1L |
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��������Լ���ǩ�ϵIJ������ݣ�ij��ѧ��ʵ����Ҫ0.5mol?L-1 H2SO4��Һ480mL��������������������Һ�������ʵ�������е�������ҩƷ����ش��������⣺
��ͼ��������Լ���ǩ�ϵIJ������ݣ�ij��ѧ��ʵ����Ҫ0.5mol?L-1 H2SO4��Һ480mL��������������������Һ�������ʵ�������е�������ҩƷ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� |
B�� |
C�� |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ�����ʧȥ���ӵ�һ��Ϊ���� |
| B����������ֱ����Դ����������һ��Ϊ���� |
| C��ԭ�������Ի��õ�һ��Ϊ���� |
| D�������з���������Ӧ��һ��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��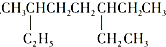 �� ��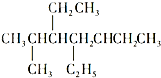 ��������̼ԭ������Ϊ7�� ��������̼ԭ������Ϊ7�� |
| B��������5��̼ԭ�ӣ��м����һ�2��֧�������������� |
| C�������顢�����顢�춡��ͱ�����۷е����ν��� |
| D��C7H16�������У�����3������ͬ���칹����2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CO2 |
| B��NO |
| C��Cl2 |
| D��SO2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com