
分析 (1)氯化铵中,铵根离子水解,浓度越大水解程度越小;
(2)氢氧化钙的溶解度随着温度的升高而减小;
(3)碳酸钠溶液中,升温促进碳酸根的水解;
(4)醋酸和醋酸钠的混合液中,醋酸的电离程度大于醋酸根的水解程度;
(5)醋酸是弱酸,稀释促进电离,盐酸是强酸,稀释过程浓度减小.
解答 解:(1)氯化铵中,铵根离子水解,铵根离子浓度越大水解程度越小,即相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数大于2L 0.5mol•L-1NH4Cl溶液中NH4+的个数,故答案为:A;
(2)两份室温时的饱和石灰水,一份升温到50℃,氢氧化钙的溶解度减小,钙离子数减小,浓度减小,另一份加入氧化钙后要消耗水,溶液仍然是饱和的,浓度不变,但钙离子数要减少,故答案为:B;
(3)碳酸钠溶液中,升温促进碳酸根的水解,所以升高温度时,碳酸氢根的浓度增大,故答案为:B;
(4)醋酸和醋酸钠的混合液中,醋酸的电离程度大于醋酸根的水解程度,导致溶液显示酸性,c(H+)>c(OH-),根据电荷守恒,所以c(Na+)<c(CH3COO-),故答案为:B;
(5)醋酸是弱酸,稀释促进电离,在体积增大导致浓度减小的同时还会电离出一部分氢离子,盐酸是强酸,稀释过程中体积增大而导致浓度减小,pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则醋酸加水多,故答案为:A.
点评 本题是一道关于盐的水解规律、弱电解质的电离平衡的影响等方面知识的综合考查题,要求学生具有分析和解决问题的能力,难度中等.


科目:高中化学 来源: 题型:多选题
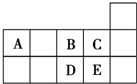
| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | A与B形成的阴离子可能有AB32-、A2B42- | |
| D. | 原子半径:A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,平衡向逆反应方向移动,c(H+)增大,KW不变 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| B. | ①中水的电离程度最小,③中水的电离程度最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:④>③,①>② | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
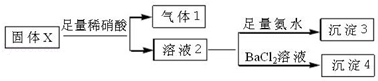
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3和KAlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com