
| A. | 1 mol任何气体的体积都为22.4 L | |
| B. | 1 mol任何物质在标准状况下所占的体积都为22.4 L | |
| C. | 标准状况下,1 mol四氯化碳所占的体积是22.4 L | |
| D. | 标准状况下,22.4 L的任何气体的物质的量都是1 mol |
科目:高中化学 来源: 题型:解答题
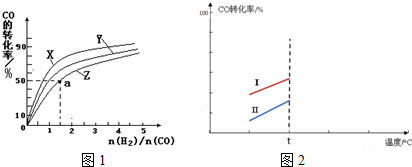
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在配制前用稀硫酸润洗容量瓶后,未用蒸馏水洗涤 | |
| B. | 定容摇匀后,发现液面低于刻度线,再加入蒸馏水至与刻度线相切 | |
| C. | 洗涤量筒,并将洗涤液转入容量瓶 | |
| D. | 定容时仰视读数. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
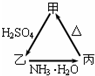 甲、乙、丙三种物质之间有如右图所示的转化关系:
甲、乙、丙三种物质之间有如右图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ③ | C. | ②⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
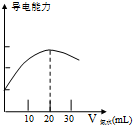 某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:
某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40K和40Ca原子中的质子数和中子数都相等 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 具有相同核电荷数的粒子,一定是同种原子的微粒 | |
| D. | 同种元素的不同核素之间互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
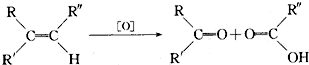 ,现有二烯烃C10H18与KMnO4溶液作用后可得到三种有机物:( CH3)2CO、CH3COOH、CH3CO(CH2)2COOH,由此推断二烯烃可能的结构简式为(CH3)2C═CHCH2CH2C(CH3)═CHCH3.
,现有二烯烃C10H18与KMnO4溶液作用后可得到三种有机物:( CH3)2CO、CH3COOH、CH3CO(CH2)2COOH,由此推断二烯烃可能的结构简式为(CH3)2C═CHCH2CH2C(CH3)═CHCH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com