
【题目】T℃时,在1 L的密闭容器中充入2 mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
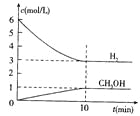
A.0~10min内v(H2)=0.3mol/(L·min)
B.T℃时,平衡常数K=![]() ,CO2和H2的转化率相等
,CO2和H2的转化率相等
C.T℃时,上述反应中有64g CH3OH生成,同时放出98.0kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
【答案】D
【解析】
A、根据图象可知,反应进行到10min时,物质的浓度不再发生变化,说明反应达到平衡状态。此时消耗氢气的浓度是6mol/L-3mol/L=3mol/L,则用氢气表示的反应速率是0.3mol/L÷10min=0.3mol/(L·min),A正确;
B、平衡时消耗CO2的浓度是1mol/L,则平衡时CO2的浓度2mol/L-1mol/L=1mol/L,所以该温度下该反应的平衡常数K=![]() =
=![]() ,B正确;
,B正确;
C、平衡时生成甲醇的物质的量64g÷32g/mol=2mol,所以放出的热量是49.0kJ/mol×2mol=98.0kJ,C正确;
D、正方应是放热反应,则升高温度平衡向逆反应方向移动,氢气的转化率降低,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是

A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
2A(g)![]() B(g)+C(g);ΔH =-48.25 kJ·mol-1,反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,下列结论正确的是
B(g)+C(g);ΔH =-48.25 kJ·mol-1,反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,下列结论正确的是
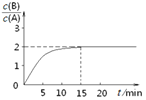
A.该温度下此反应的平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡时,放出的热量是193kJ
D.反应达平衡时,A的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+3B(g)![]() 2C(g)+2D(g)中,反应速率最快的是
2C(g)+2D(g)中,反应速率最快的是
A.υ(A)=0.02mol/(Ls)B.υ(B)=0.04 mol/(Ls)
C.υ(C)=1.2mol/(Lmin)D.υ(D)=1.8mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对在密闭容器中进行的可逆反应:4NH3(g)+5O2![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=1∶1
B.反应达到平衡后,再向体系中充入O2,将提高NH3的转化率
C.反应达到平衡时,若向体系中充入稀有气体,速率增大
D.当v正(NH3):v正(NO)=1∶1时,说明该化学反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,2molX和2molY进行如下反应:2X(g)+Y(g)Z(g),经2min达到平衡,生成0.6molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.06mol/(Lmin)
B.将容器体积变为20L,Z的平衡浓度为原来的![]()
C.平衡时,X的转化率为30%
D.起始状态和平衡时容器内的气体压强比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
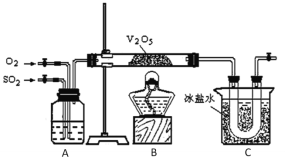
(1)已知450℃时,反应2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)
2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)![]() 2SO2(g)+O2(g)的化学平衡常数为___。
2SO2(g)+O2(g)的化学平衡常数为___。
(2)A中的试剂是___。
(3)在实验过程中不必持续加热,说明该平衡的△H___0(填“>”或“=”或“<”),C装置用来收集三氧化硫,其中冰盐水的作用是___;若用32g铜跟足量浓硫酸反应制取二氧化硫,实验结束时得到20g三氧化硫,该实验中二氧化硫的转化率不小于___。
(4)请指出本套实验装置的明显缺陷是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气(CO和H2)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
(1)该反应的平衡常数的表达式为_________________;升高温度,K值将________;容器中气体的平均相对分子质量将________。(填“增大”、“减小”或“不变”)。
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡将________(填字母)。
A.向左移 B.向右移 C.不移动
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有________(填字母)。
A.单位体积内每消耗1 mol CO的同时生成1 mol H2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+H2O(g)![]() CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com