
向一定浓度的NaHCO3溶液中加入适量下列物质,一定能使HCO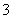 数目减少,CO
数目减少,CO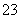 数目增加的是( )
数目增加的是( )
A.稀盐酸 B.Ba(OH)2溶液
C.NaOH溶液 D.Na2SO4溶液
科目:高中化学 来源: 题型:
有关①100mL 0.1mol/L NaHCO3 ②100mL 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO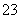 )>c(H2CO3)
)>c(H2CO3)
D.②溶液中:c(HCO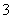 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol Na2CO3·10H2O晶体中,阴离子总数大于0.1NA
B.常温常压下,18 mL水中所含氢离子数约为10-7NA
C.标准状况下,22.4 L氦气中含有的原子数约为NA
D.23 g组成为C2H6O的有机物,C—H键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______________________________________________________________。
(2)已知:甲醇脱水反应 2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应 2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是__________________________。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n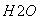 :n
:n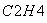 =1:1]
=1:1]
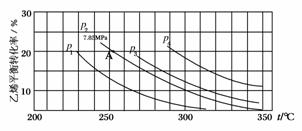
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强p1、p2、p3、p4的大小顺序为:________,理由是:______________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9 MPa,n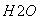 :n
:n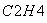 =0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
=0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速度v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合溶液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3。已知下表数据:
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | 3~4 |
下列叙述正确的是( )
A.混合溶液中:c(SO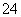 )[c(Cu2+)+c(Fe2+)+c(Fe3+)]=54
)[c(Cu2+)+c(Fe2+)+c(Fe3+)]=54
B.若向混合溶液中加入铁粉,不可能观察到红色固体析出
C.若向混合溶液中加入足量氯水,调节pH到3~4后过滤,得到纯净的CuSO4溶液
D.若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象不能说明相关结论的是( )
A.将铜与浓硫酸共热,产生 使石蕊溶液变红的气体,说明浓硫酸具有酸性
使石蕊溶液变红的气体,说明浓硫酸具有酸性
B.将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动
D.向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
硫是一种很活泼的元素,在适宜的条件下能形成-2、+6、+4、+2、+1价的化合物。
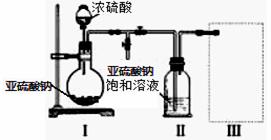 I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
(1)装置I中的浓硫酸______ (能或不能)用稀硫酸代替,
原因是 。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的分离方法是_____________。
(3)装置Ⅲ用于处理尾气,请在虚线内画出尾气处理装置和药品。
(4)检验Na2S2O5晶体在空气中变质的实验方案是 。
II:而另一种硫的化合物Na2S2O3的溶液可以用于测定溶液中ClO2的含量,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是 。
(2)确定滴定终点的现象为__________________________________。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
(4)下列操作会导致测定结果偏高的是 。
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定应在中性或弱酸性环境中进行,若溶液呈碱性
E.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、Na+ 、Cl-、SO42- B.Cu2+、Ca2+ 、CO32- 、Cl-
C.NH4+、 Ba2+ 、NO3-、HCO3- D.K+ 、Fe3+、Cl- 、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com