
����Ŀ��һ�������������Ժ�CO2������Ӧ��Fe(s)+CO2(g) ![]() FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0
��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ����ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)=______��

��2��д���÷�Ӧƽ�ⳣ����ʽ��K=__________�����д�ʩ����ʹ�÷�Ӧ��ƽ�ⳣ��K�������____������ţ���
A�������¶� B������ѹǿ C������CO D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��������CO2����CO2��ת���ʽ�______ �����������С���������䡱����
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺��
�ٸ�������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ____________��
�ڸ�����ص��ܷ�ӦΪ��3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
���������������____������ţ���
A���ŵ�ʱÿת��6mol���ӣ�������2mol K2FeO4����ԭ
B�����ʱ������ӦΪ��Zn(OH)2 +2e-=Zn+ 2OH-
C���ŵ�ʱ������ӦΪ��FeO42-+ 3e-+ 4H2O= Fe(OH)3+ 5OH-
D�����ʱ����������Һ�ļ��Լ���
��5����֪��2CO(g)+O2(g)= 2CO2(g) ��H=-566 kJ/mol
2H2(g)+ O2(g)= 2H2O(g)����H=-483.6 kJ/mol
д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ��____________��
���𰸡� 0.075mol/(L��min) K=c(CO)/c(CO2) A ���� 2Fe(OH)3+3ClO- +4OH- =2FeO42-+3Cl-+5H2O A CO (g) +H2O(g)=CO2 (g) +H2 (g) ��H=-41.2kJ/mol
����������1����ͼ��8min�ڣ�c(CO)=0.60mol/L����CO��ƽ����Ӧ����v(CO)=c(CO)��t(CO)=0.60mol/L��8min=0.075mol/(L��min)��
��2����һ���¶��£����淴Ӧ���ﵽƽ�⣬��������Ũ�ȵĻ�ѧ���������ݵij˻������Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻��ı�ֵ�Ǹ���������K��ʾ����������л�ѧƽ�ⳣ�����ٽ�ϸ÷�Ӧ��ѧ����ʽ��ƽ�ⳣ����ʽK=c(CO)/c(CO2)����ѧƽ�ⳣ��ֻ���¶�Ӱ�죬����֪�÷�ӦΪ���ȷ�Ӧ���������¶�ƽ�ⳣ��K����ֻ��Aѡ��������⡣
��3���÷�ӦΪ��Ӧǰ���������������ķ�Ӧ����Ӧ�ﵽƽ��������������������ʱ����ͨ��������CO2���ﵽ��ƽ����ԭƽ���Ч����CO2��ת���ʲ��䡣
��4����ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ������������ԭ���غ�͵�ʧ�����غ��֪��һ�ֳ��������ﺬ����Ԫ�أ�ӦΪˮ�����ݵ���غ㣬���ӷ���ʽΪ2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O����A�������طŵ�ʱ��пԪ�صĻ��ϼ����ߣ���Ԫ�ػ��ϼ۽���(��+6��Ϊ+3)��K2FeO4�������Ϸ�����ԭ��Ӧ��ÿת��6mol���ӣ�����������2molK2FeO4����ԭ����A����B����ʱ����Zn(OH)2�����õ��ӵĻ�ԭ��Ӧ���������ҺΪ���ԣ��缫��ӦΪ��Zn(OH)2+2e-=Zn+2OH-����B��ȷ��C��ŵ�ʱ��������K2FeO4�õ��ӵĻ�ԭ��Ӧ���������ҺΪ���ԣ��缫��ӦΪ��FeO42-+3e-+4H2O=Fe(OH)3+5OH-����C��ȷ��D����ʱ��������Fe(OH)3ʧ���ӵ�������Ӧ����Fe(OH)3+5OH--3e-=FeO42-+4H2O���������������ӣ����Գ��ʱ����������Һ�ļ��Լ�������D��ȷ��
��5������֪��������Ӧ�ֱ�Ϊ����2CO(g)+O2(g)=2CO2(g) ��H=-566kJ/mol����2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ/mol�����ݸ�˹���ɢ�-�ڵã�2CO(g)+2H2O(g)=2CO2(g)+2H2(g)��H=-82.4kJ/mol������CO(g)+H2O(g)=CO2(g)+H2(g) ��H=-41.2kJ/mol��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98%��Ũ����(��=1.84 g/cm3)����1 mol/Lϡ����100 mL��
(1)ʵ�������
a����100mL��Ͳ��ȡ98%��Ũ����___________mL��
b��ѡȡ��Ӧ��������ƿ��ϴ�ӣ�����Ƿ�©Һ����ϡ�Ͳ���ȴ�����µ�������Һ�ز�����ת�Ƶ�������ƿ�У�
c������������ˮϴ��С�ձ��Ͳ�����2~3�Σ�����ϴ��Һת�Ƶ�����ƿ�У�
d����С�ձ���ϡ��Ũ���ᣬϡ��ʱҪ�ò��������Ͻ��裻
e��������ƿ��ֱ�Ӽ�����ˮ����̶���1~2 cm����
f����������ƿƿ����ҡ�ȣ�
g���ý�ͷ�ι�С�ļ�����ˮ���̶��ߣ�
h�������ƺõ���Һת���뺬��������ˮ���Լ�ƿ�����汸�á�
(2)ʵ��
����ȷ�IJ���������__________________________________________________(�����)��
�ڴ�ʵ���в�������������__________________________________________________��
��ʵ����������������������������ǣ�________________________��_________________________��
(3)���в�����������Һ��Ũ���к�Ӱ�죿(�ƫ�ߡ���ƫ�͡�����Ӱ�족)
����ȡŨ�������Ͳ������ˮϴ�����Σ�����ϴ��Һת������ƿ��______________��
�ڶ���ʱ��������ƿ�̶���________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)д�����з�Ӧ�Ļ�ѧ����ʽ����˫���ŷ���������ת�Ƶķ������Ŀ����ע��������������������ԭ����
��Fe2O3��CO�ڸ����µķ�Ӧ��___________________________________��
��KClO3��MnO2�ڹ��������·�Ӧ��________________________________��
��H2S�����SO2���巴Ӧ����S��ˮ��______________________________��
(2)д�����з�Ӧ�����ӷ���ʽ�����õ����ŷ���������ת�Ƶķ������Ŀ��
��Cu��AgNO3��Һ��Ӧ��________________________________________��
��ʵ������Cl2�ķ�ӦΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��___________________________��
MnCl2+Cl2��+2H2O��___________________________��
����FeCl2��Һ��ͨ��Cl2����FeCl3��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�ý���ʵ�飬�ס��������о�Ϊ1 mol��L��1��AgNO3��Һ��A��B��ΪAg�缫��ʵ�鿪ʼʱ�ȱպ�K1���Ͽ�K2��һ��ʱ��Ͽ�K1���պ�K2���γ�Ũ���أ�������ָ��ƫת(Ag��Ũ��Խ��������Խǿ)������˵������ȷ����(����)

A. �պ�K1���Ͽ�K2��A�缫����
B. �պ�K1���Ͽ�K2���ҳ���ҺŨ������
C. �Ͽ�K1���պ�K2��A�缫����������Ӧ
D. �Ͽ�K1���պ�K2��NO![]() ��B�缫�ƶ�
��B�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ά����C�ֳ�Ϊ����Ѫ�ᣬ������������Ҫ�Ĺ��ܡ����磬�������彫ʳ������ȡ�IJ������յ�Fe3+��Ϊ�����յ�Fe2+����˵��ά����C����________(������ԡ���ԭ�ԡ�)��
(2)2Na+O2![]() Na2O2��Ӧ�У�
Na2O2��Ӧ�У�
��________��������________��������������������_______��������������Ԫ�صĻ��ϼ���_______��
�ڴ˷�Ӧ����ת����2 mol�ĵ��ӣ�����Ҫ����________ mol��
���õ����Ż�˫���ŷ���ʾ��Ӧ�е���ת�Ƶķ������Ŀ��______________________��
(3)���ݷ�Ӧ��2FeCl3+2KI��2FeCl2+2KCl+I2����2FeCl2+Cl2��2FeCl3���ж��������ʵ���������ǿ������˳���У���ȷ����____________��
A��Fe3+>Cl2>I2 B��Cl2>I2>Fe3+
C��I2>Cl2>Fe3+ D��Cl2>Fe3+>I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ŵ���Ϣ��Я���ߺ����������Ҫ�е��߷ֱ��ǣ� ��
�ٺ��� �ں��Ǻ��� ���������Ǻ��� �ܵ����� ��֬�� ������
A. �٢� B. �ڢ� C. �ۢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. �Ȼ�����Һ�м��������ˮ��Al3++4NH3��H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. ����ʯ��ˮ�������մ���Һ��ϣ�Ca2++OH-+HCO3-![]() CaCO3��+H2O
CaCO3��+H2O
C. ̼������ڴ��CaCO3+2H+![]() Ca2++CO2��+H2O
Ca2++CO2��+H2O
D. �Ȼ�������Һ��ͨ��������2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C����Ԫ�����ڱ��еĶ�����Ԫ�أ����ǵĺ˵������������2����Ԫ��Aԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������2����Bԭ�ӵ������p����ĵ���Ϊ�������ṹ��C�ǵؿ��к�������Ԫ�ء�D�ǵ�������Ԫ�أ���ԭ�Ӻ�����������������ԭ����ͬ�����������Ӿ����������ö�Ӧ��Ԫ�ط��Ż�ѧʽ��գ�
(1)A��B��C�ĵ�һ��������С�����˳��Ϊ ��
(2)A����ۺ������������������ԭ�Ӳ�ȡ �ӻ���
(3)��A��B�γɵ�������(AB��)��Ϊ�ȵ�����ķ����� ��
(4)��̬Dԭ�ӵĺ�������Ų�ʽΪ ����ͼ�ǽ���Ca��D���γɵ�ij�ֺϽ�ľ����ṹʾ��ͼ����úϽ���Ca��D��ԭ�Ӹ�����Ϊ ��

(5)��D�ĸ�̬��������Һ����εμ�B���⻯��ˮ��Һ���������ȳ��ֳ������������ܽ��γ���Һ��д���˳����ܽ�����ӷ���ʽ��_ ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����һ�������µ����п��淴Ӧ�ﵽƽ��ʱ���������x A��y B![]() z C
z C
��1����A��B��C�������壬�ڼ�ѹ��ƽ�����淴Ӧ�����ƶ�����x��y��z��ϵ��________��
��2����C�����壬����x+y=z���ڼ�ѹʱ��ѧƽ��ɷ����ƶ�����ƽ��ض�����_____�����ƶ���
��3����֪B��C�����壬������A���ʵ�����ƽ�ⲻ�ƶ���˵��A��______����״̬����
��4������Ⱥ�C�İٷֺ�����С��������Ӧ��________�ȷ�Ӧ��
II����ͼ��ʾ��A�г���1 mol X ��1 mol Y����B�г���2 mol X��2mol Y����ʼʱ��V��A��=V��B��= a L������ͬ�¶Ⱥ��д��������£��������и��Է���������Ӧ��X(g)+Y(g)![]() 2Z(g)+W(g) ��H��0���ﵽƽ��ʱ��V��A��= 1.2a L��
2Z(g)+W(g) ��H��0���ﵽƽ��ʱ��V��A��= 1.2a L��
�Իش�
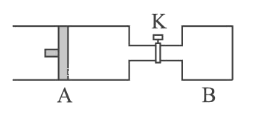
��1��A��X��ת������(A)___________________________��
��2��A��B��X��ת���ʵĹ�ϵ����(A) ___________��(B)��(������������������=��)
��3����K��һ��ʱ���ִﵽƽ�⣬A�����Ϊ___________L������ͨ��������������ƣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com