
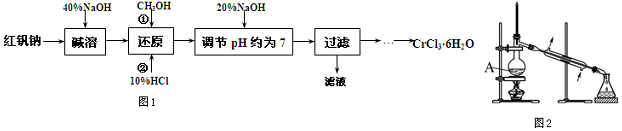
分析 用40%NaOH将红矾钠(Na2Cr2O7)转化为铬酸钠(Na2CrO4),再用CH3OH将铬酸钠(Na2CrO4)还原为CrCl3溶液,加20%NaOH使Cr3+沉淀为Cr(OH)3,过滤,将过滤后所得固体用盐酸溶解,最后将CrCl3的HCl溶液进行蒸发浓缩、冷却结晶、过滤并用乙醚洗涤2~3次,低温干燥,即得CrCl3•6H2O晶体.
(1)根据已知:①Cr2O72-+H2O?2CrO42-+2H+,碱溶的目的使平衡正向移动.所加40%NaOH不宜过量太多,因后需加更多的盐酸还原;
(2)还原时是CH3OH与CrO42-之间的反应,CH3OH将铬酸钠(Na2CrO4)还原为CrCl3溶液;
(3)测定溶液的pH可用pH计、pH试纸;
(4)①由装置图可知仪器名称;
②CH3OH参与反应的体系是水溶液;
(5)抑制CrCl3的水解,将过滤后所得固体用盐酸溶解、蒸发浓缩.减小CrCl3•6H2O晶体的溶解,用乙醚洗涤.
解答 解:(1)碱溶使Cr2O72-+H2O?2CrO42-+2H+的平衡正向移动,将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-);所加40%NaOH不宜过量太多,因后需加更多的盐酸还原,故答案为:将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-);避免还原时消耗过多盐酸;
(2)CH3OH将铬酸钠(Na2CrO4)还原为CrCl3溶液,反应为10H++2CrO42-+CH3OH=2Cr3++7H2O+CO2↑,
故答案为:10H++2CrO42-+CH3OH=2Cr3++7H2O+CO2↑;
(3)测定溶液的pH可用pH计、pH试纸,故答案为:AB;
(4)①由装置图可知仪器名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
②CH3OH参与反应的体系是水溶液,因此没有必要加入CaO,故答案为:没有必要,CH3OH参与反应的体系中有水;
(5)过滤后所得Cr(OH)3用过量的盐酸溶解,最后将CrCl3的HCl溶液进行蒸发浓缩、冷却结晶、过滤并用乙醚洗涤2~3次,即得CrCl3•6H2O晶体,
故答案为:完全溶解于过量的盐酸中;蒸发浓缩;用乙醚洗涤固体2~3次.
点评 本题考查了CrCl3•6H2O的制取原理及除杂方法,为高频考点,侧重于学生的分析能力、实验能力的考查,注意合理分析题中信息,难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题


 .检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.
.检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4NA个Cl原子 | |
| B. | 16gO2和O3组成的混合气体中含有的原子数为NA | |
| C. | 1 mol Na2O2与足量H2O完全反应,转移电子数为2 NA | |
| D. | 78g Na2O2所含的阴离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:2 | B. | 2:3:3 | C. | 6:3:1 | D. | 2:3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com