
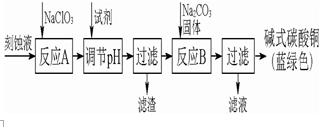
 ¼īŹ½Ģ¼ĖįĶŹĒŅ»ÖÖÓĆĶ¾¹ć·ŗµÄ»Æ¹¤ŌĮĻ£®¹¤ŅµÉĻæÉÓĆĖįŠŌæĢŹ“·ĻŅŗ£ØÖ÷ŅŖ³É·ÖÓŠCu2+”¢Fe2+”¢Fe3+”¢H +”¢Cl-£©Öʱø£¬ĘäÖʱø¹ż³ĢČēĶ¼Ķ¼ĖłŹ¾£®Cu2+”¢Fe2+”¢Fe3+Éś³É³ĮµķµÄpHČē±ķøńĖłŹ¾£ŗ
¼īŹ½Ģ¼ĖįĶŹĒŅ»ÖÖÓĆĶ¾¹ć·ŗµÄ»Æ¹¤ŌĮĻ£®¹¤ŅµÉĻæÉÓĆĖįŠŌæĢŹ“·ĻŅŗ£ØÖ÷ŅŖ³É·ÖÓŠCu2+”¢Fe2+”¢Fe3+”¢H +”¢Cl-£©Öʱø£¬ĘäÖʱø¹ż³ĢČēĶ¼Ķ¼ĖłŹ¾£®Cu2+”¢Fe2+”¢Fe3+Éś³É³ĮµķµÄpHČē±ķøńĖłŹ¾£ŗ| ĪļÖŹ | Cu£ØOH£©2 | Fe£ØOH£©2 | Fe£ØOH£©3 |
| æŖŹ¼³ĮµķpH | 4.2 | 5.8 | 1.2 |
| ĶźČ«³ĮµķpH | 6.7 | 8.3 | 3.2 |
·ÖĪö ÓÉÖʱøĮ÷³ĢæÉÖŖ£¬·ĻŅŗÖŠ¼ÓČė“ĪĀČĖįÄĘ½«ŃĒĢśĄė×ÓŃõ»Æ³ÉĢśĄė×Ó£¬Č»ŗóÓĆĒāŃõ»ÆĶ»ņĢ¼ĖįĶµ÷½ŚČÜŅŗµÄpHÉś³ÉĒāŃõ»ÆĢś³żČ„ĢśĄė×Ó£¬¹żĀĖŗó¼ÓČėĢ¼ĖįÄĘČÜŅŗÉś³É¼īŹ½Ģ¼ĖįĶ£¬¹żĀĖŗóµĆµ½¼īŹ½Ģ¼ĖįĶ£¬
£Ø1£©ŃĒĢśĄė×Ó²»ČŻŅ׳żČ„£¬ŠčŅŖ¼ÓČė“ĪĀČĖįÄĘ½«ŃĒĢśĄė×ÓŃõ»Æ³ÉĢśĄė×Ó£¬±ćÓŚ³żČ„ŌÓÖŹ£»
£Ø2£©µ÷½ŚpHŹ¹µĆĢśĄė×Ó³ĮµķĶźČ«£¬¶ųĶĄė×Ó²»ÄÜæŖŹ¼³Įµķ£¬ĪŖĮĖ²»ŅżČėŌÓÖŹ£¬×īŗĻŹŹµÄĪļÖŹČēCuO”¢Ģ¼ĖįĶ£»
£Ø3£©·“Ó¦BµÄĪĀ¶ČČē¹żøߣ¬Ģ¼ĖįĶŗĶŃõ»ÆĶŹÜČČ·Ö½āĪŖŃõ»ÆĶ£»
£Ø4£©Č”×īŗóŅ»“ĪĻ“µÓŅŗÉč¼ĘŹµŃéÓĆĻõĖįĖį»ÆµÄĻõĖįŅųČÜŅŗ¼ģŃéŹĒ·ńŗ¬ÓŠĀČĄė×ÓÉč¼Ę¼ģŃ飻
£Ø5£©¢ŁCu2+ŗĶCO32-Éś³ÉCuCO3³Įµķ£»
¢ŚCu2+ŗĶCO32-ŗĶĖ®·“Ӧɜ³ÉCu£ØOH£©2³ĮµķŗĶ¶žŃõ»ÆĢ¼£®
½ā“š ½ā£ŗ£Ø1£©ÓÉÓŚ³ĮµķĒāŃõ»ÆŃĒĢśµÄpH“óÓŚ³ĮµķĒāŃõ»ÆĢśµÄpH£¬ĖłŅŌÓ¦øĆ°ŃŃĒĢśĄė×ÓŃõ»ÆÉś³ÉĢśĄė×Ó£¬Č»ŗóŌŁ×Ŗ»ÆĪŖ³Įµķ£¬ĖłŅŌĀČĖįÄʵÄ×÷ÓĆŹĒ½«Fe2+Ńõ»Æ³ÉFe3+£¬
ĀĖŌüĪŖĢśĄė×ÓĶźČ«³ĮµķµĆµ½µÄĒāŃõ»ÆĢś³Įµķ£»
¹Ź“š°øĪŖ£ŗ½«Fe2+Ńõ»Æ³ÉFe3+²¢×īÖÕ³żČ„£»Fe£ØOH£©3£»
£Ø2£©µ÷½ŚpHŹ¹µĆĢśĄė×Ó³ĮµķĶźČ«£¬¶ųĶĄė×Ó²»ÄÜæŖŹ¼³Įµķ£¬µ÷½Ś·“Ó¦AŗóČÜŅŗµÄpH·¶Ī§Ó¦ĪŖ3.2-4.2£»°±Ė®”¢ĒāŃõ»ÆÄĘ”¢MgO¾łŅżČėŌÓÖŹĄė×Ó£¬ĪŖĮĖ²»ŅżČėŌÓÖŹ£¬×īŗĻŹŹµÄ¼īŠŌĪļÖŹŹĒb”¢d£¬
¹Ź“š°øĪŖ£ŗ3.2-4.2£»bd£»
£Ø3£©·“Ó¦BµÄĪĀ¶ČČē¹żøߣ¬Ģ¼ĖįĶŗĶŃõ»ÆĶ¾łæÉŹÜČČ·Ö½āÉś³ÉŃõ»ÆĶ£¬¹Ź“š°øĪŖ£ŗCuO£»
£Ø4£©×īŗó¹żĀĖµĆµ½µÄ²śĘ·Ļ“µÓŹ±£¬ÅŠ¶Ļ²śĘ·ŅŃ¾Ļ“¾»µÄ·½·ØŗĶ²½ÖčĪŖ£ŗČ”×īŗóŅ»“ĪĻ“µÓŅŗ£¬¼ÓČėĻõĖįŅųŗĶĻ”ĻõĖį£¬ĪŽ³ĮµķÉś³ÉŌņ±ķĆ÷ŅŃĻ“µÓøɾ»£»
¹Ź“š°øĪŖ£ŗČ”×īŗóŅ»“ĪĻ“µÓŅŗ£¬¼ÓČėĻõĖįŅųŗĶĻ”ĻõĖį£¬ĪŽ³ĮµķÉś³ÉŌņ±ķĆ÷ŅŃĻ“µÓøɾ»£»
£Ø5£©¢Ł½«Na2CO3ČÜŅŗµĪČėµ½Ņ»¶ØĮæCuCl2ČÜŅŗÖŠµĆµ½³Įµķ£¬Cu2+ŗĶCO32-Éś³ÉCuCO3³Įµķ£¬Ąė×Ó·½³ĢŹ½ĪŖCu2++CO32-=CuCO3”ż£¬
¹Ź“š°øĪŖ£ŗCu2++CO32-=CuCO3”ż£»
¢ŚCu2+ŗĶCO32-ŗĶĖ®·¢ÉśĖ«Ė®½ā·“Ӧɜ³ÉCu£ØOH£©2³ĮµķŗĶ¶žŃõ»ÆĢ¼£¬Ąė×Ó·½³ĢŹ½ĪŖCu2++CO32-+H2O=Cu£ØOH£©2”ż+CO2”ü£¬
¹Ź“š°øĪŖ£ŗCu2++CO32-+H2O=Cu£ØOH£©2”ż+CO2”ü£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄÖʱøŹµŃ飬ĪŖøßæ¼³£¼ūĢāŠĶ£¬°ŃĪÕÖʱøĮ÷³Ģ¼°·¢ÉśµÄ·“Ó¦ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶŹµŃéÄÜĮ¦µÄ漲飬עŅāŃõ»Æ»¹Ō·“Ó¦”¢ŃĪĄąĖ®½ā¼°±ķøńŹż¾ŻµÄÓ¦ÓĆ£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¶žŃõ»ÆĢ¼ÓĆÓŚĆš»š | B£® | ŃõĘų¹©øųŗōĪü | ||
| C£® | ½šøÕŹÆÓĆ×÷ןĢ½»śµÄןĶ· | D£® | ÓĆĆ¾ÖĘ×÷ÕÕĆ÷µÆ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÅضČĪŖ0.1mol/L | B£® | ÅضČĪŖ1mol/L | C£® | ŗ¬NaOH 4g | D£® | ŗ¬NaOH 0.1mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com