
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-═H2O | |
| B. | H2O的电离方程式:H2O+H2O?H3O++OH- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+H+═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
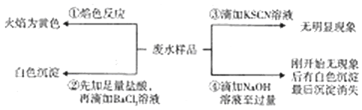
| A. | 废水含有Na+,不含K+ | B. | 废水含有SO42-和CO32- | ||
| C. | 废水不含Fe3+,可能含Fe2+ | D. | 废水一定含有Na+、Al3+、SO42-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
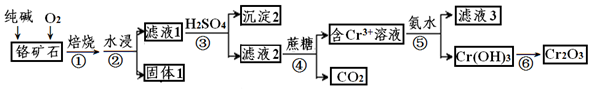
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
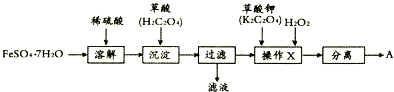
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
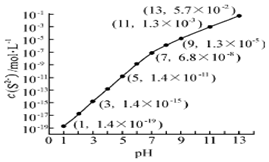 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.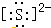 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com