
合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:
Cu(NH3)2Ac + CO + NH3  [Cu(NH3)3]Ac·CO + Q
[Cu(NH3)3]Ac·CO + Q
生产中必须除去原料气中CO的原因是 ;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是 。
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
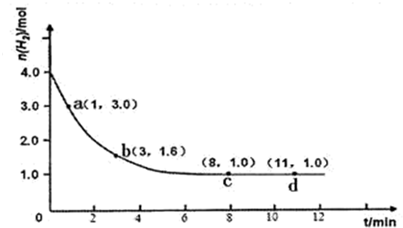


| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T/K | 298 | 398 | 498 |
| K | 4.1×106 | K1 | K2 |

| O |
查看答案和解析>>
科目:高中化学 来源: 题型:
[Cu(NH3)2·OOCCH3]+CO+NH3![]() [Cu(NH3)3]OOCCH3·CO(正反应是放热反应),请完成下列问题:
[Cu(NH3)3]OOCCH3·CO(正反应是放热反应),请完成下列问题:
(1)必须除去原料气中的CO的原因是______________________________________________。
(2)醋酸二氨合铜(Ⅰ)吸收CO的适宜生产条件是____________________________________。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可以再生,恢复其吸收CO的能力,以供循环使用,醋酸铜氨液再生的适宜条件是________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省太原五中高二8月月考化学试卷(带解析) 题型:填空题
合成氨工业中,原料气(N2、H2及少量的CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2Ac]+CO+NH3  [Cu(NH3)3] Ac·CO;(△H<0)
[Cu(NH3)3] Ac·CO;(△H<0)
⑴醋酸二氨合铜(I)吸收CO的生产适宜条件是 ;
⑵吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨液再生的适宜条件是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com