
| ||
| ||
| ||
| ||
| 2 |
| 5 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 5 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 5 |
| ||
| ||
| 2 |
| 5 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 3 |
| 3 |
| 2 |
| ||
| 3 |
| 2 |


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、NaCl |
| B、Na2C03 |
| C、NaOH |
| D、CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷与Cl2在光照下反应,每有NA个氢原子被氯替代,需消耗标准状况下Cl2 11.2L |
| B、1mol苯中含有3NA个碳碳双键 |
| C、14g乙烯和丙烯的混合物中含有3NA对共用电子对 |
| D、标准状况下,22.4L己烷中的碳原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
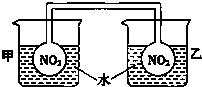 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.查看答案和解析>>
科目:高中化学 来源: 题型:
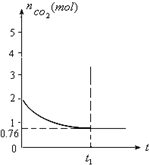 一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:
一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中溶质微粒作有规律的运动,胶体粒子运动无规律 |
| B、溶液中溶质微粒一定不带电,胶体中分散质微粒带电荷 |
| C、溶液中通过一束光,无特殊现象,而胶体中有“光亮的通路” |
| D、溶液呈电中性,胶体带有电荷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com