
| A��2H+��aq��+SO42-��aq��+Ba2+��aq��+2OH-��aq��=BaSO4��s��+2H2O��1����H=-57.3 kJ/mol | ||||
B��KOH��aq��+
| ||||
C��C8H18��l��+
| ||||
| D��2C8H18��g��+25O2��g��=16CO2��g��+18H2O��1����H=-5518 kJ/mol |
| 25 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��146 | B��114 |
| C��92 | D��46 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������118 |
| B�����ǵڰ�����Ԫ�� |
| C�����ǻ��õĽ���Ԫ�� |
| D������������������8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
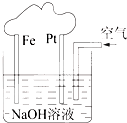
| A������һ������װ�� |
| B�����ǵ��NaOH��Һ��װ�� |
| C����װ����FeΪ�������缫��ӦΪ��Fe-2e-+2OH-=Fe��OH��2 |
| D����װ����PtΪ�������缫��ӦΪ��O2+2H2O+4e-=4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ձ���һ�����ᷢ�������ӷ�Ӧ�У�2Na+2H2O=2Na++2OH-+H2�� |
| B�������ձ����ƾ���Һ���Ͼ��ҷ�Ӧ����ȶ��ԣ�X�ձ��еķ�Ӧƽ��Щ |
| C��Z�ձ���һ�����г������ɣ����������ǵ���ͭ |
| D�������ձ����û�������������ʵ���һ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����0.45moL |
| B������0.45moL |
| C����0.45-0.90 moL ֮�� |
| D������0.90 moL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ҫ���ȷ��ܷ����ķ�Ӧ��һ�������ȷ�Ӧ |
| B����Ӧ�����Ȼ��Ƿ���ȡ���ڷ�Ӧ��������������е�����������Դ�С |
| C���ⶨ�кͷ�Ӧ�ķ�Ӧ��ʱ������к�֮��Ӧ��ȡ��ϵ�ﵽ������¶� |
| D������������ȼ�գ��÷�Ӧ��Ӧ��������ʴ��ڷ�Ӧ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com