
| A. | 离子半径X>Y>Z | |
| B. | 元素原子得电子能力X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性强弱X>Y>Z | |
| D. | 单质与氢气反应,X、Y、Z难度依次增大 |
分析 电子层数相同的三种元素X、Y、Z,说明它们属于同一周期元素,同一周期元素,非金属性随着原子序数增大而增强,元素的非极性越强,其氢化物的稳定性越强,因为它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,所以原子序数X>Y>Z,非金属性X>Y>Z,
A.电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其原子得电子能力越强;
C.元素的非极性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
D.元素的非金属性越强,其单质与氢气越容易化合.
解答 解:电子层数相同的三种元素X、Y、Z,说明它们属于同一周期元素,同一周期元素,非金属性随着原子序数增大而增强,元素的非极性越强,其氢化物的稳定性越强,因为它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,所以原子序数X>Y>Z,非金属性X>Y>Z,
A.电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径X<Y<Z,故A错误;
B.元素的非金属性越强,其原子得电子能力越强,非金属性X>Y>Z,所以元素原子得电子能力X>Y>Z,故B正确;
C.元素的非极性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,如果X是F、Y是O元素,二者没有最高价氧化物的水化物,故C错误;
D.元素的非金属性越强,其单质与氢气越容易化合,非金属性X>Y>Z,所以单质与氢气反应X、Y、Z难度依次增大,故D正确;
故选AC.
点评 本题考查原子结构和元素周期律,为高频考点,明确同一周期原子结构和元素周期律的关系是解本题关键,注意规律中的反常现象,易错选项是C,O、F元素没有最高价氧化物的水化物,


科目:高中化学 来源: 题型:填空题
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
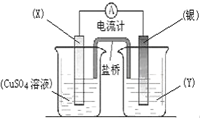 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈中性 | B. | 呈碱性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO(g)+H2(g).
CO(g)+H2(g).| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稳定性:A2D<A2X | |
| B. | CA3分子的立体结构为平面三角形 | |
| C. | C形成的单质中σ键与π键个数之比为1:2 | |
| D. | B、C、D形成的气态氢化物互为等电子体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com