
 ,B
,B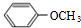 ,C
,C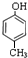 .
. 分析 A、B、C三种物质化学式都是C7H8O,不饱和度=$\frac{7×2+2-8}{2}$=4,若滴入FeCl3溶液,只有C呈紫色,说明C中含有酚羟基,由分子式知,还含有-CH3,C苯环上的一溴代物有两种结构,说明甲基与羟基处于对位;若投入金属钠,只有B没有变化,则B中没有羟基,A、C中含有羟基,故B中含有醚键,侧链为-OCH3;
A中含有醇羟基,侧链为-CH2OH,据此分析解答.
解答 解:A、B、C三种物质化学式都是C7H8O,不饱和度=$\frac{7×2+2-8}{2}$=4,若滴入FeCl3溶液,只有C呈紫色,说明C中含有酚羟基,由分子式知,还含有-CH3,C苯环上的一溴代物有两种结构,说明甲基与羟基处于对位,所以C为 ;若投入金属钠,只有B没有变化,则B中没有羟基,A、C中含有羟基,故B中含有醚键,侧链为-OCH3,所以B为
;若投入金属钠,只有B没有变化,则B中没有羟基,A、C中含有羟基,故B中含有醚键,侧链为-OCH3,所以B为 ,A中含有醇羟基,侧链为-CH2OH,所以A为
,A中含有醇羟基,侧链为-CH2OH,所以A为 ,
,
故答案为: ;
; ;
; .
.
点评 本题考查有机物推断,为高频考点,明确有机物官能团及其性质关系是解本题关键,知道酚羟基性质的特殊性,题目难度不大.


科目:高中化学 来源: 题型:解答题
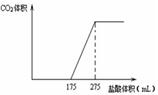 取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:
取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
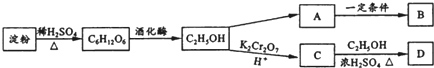
 .
.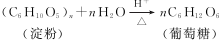 ;
;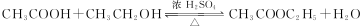
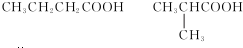 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
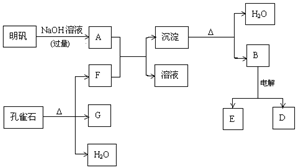
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 3:4 | C. | 2:1 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com