
分析 设物质的量均为1mol,结合V=nVm、N=nNA、ρ=$\frac{M}{Vm}$及分子构成计算.
解答 解:相等物质的量的CO和CO2,设物质的量均为1mol,则
①由N=nNA可知,所含分子数目之比为1:1,故答案为:1:1;
②所含O原子数目之比为1:1×2=1:2,故答案为:1:2;
③由V=nVm可知,相同条件下的体积之比为1:1,故答案为:1:1;
④由ρ=$\frac{M}{Vm}$可知,相同条件下的密度之比为28:44=7:11,故答案为:7:11.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意摩尔质量与密度的关系,题目难度不大.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3要在沸水中才能发生水解 | |
| B. | 放热反应不需要加热就能进行 | |
| C. | 将pH=2的硫酸溶液加热至100℃时pH基本不变 | |
| D. | 加热不利于合成氨,故工业上采用低温合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼铜过程中阴极增重6.4 g时,电路中转移电子数大于0.2NA | |
| B. | 标准状况下,11.2 L氨气溶于水配制成500 mL溶液,溶液中NH4+数目为0.5NA | |
| C. | 1 mol D318O+中含有的中子数为10NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
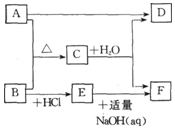 A、B、C、D、E、F是中学化学中的常见物质,它们之间的转化关系如图所示.其中 A、B为单质,F为白色沉淀,D为气体.
A、B、C、D、E、F是中学化学中的常见物质,它们之间的转化关系如图所示.其中 A、B为单质,F为白色沉淀,D为气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子个数比为4:5 | B. | 含硫元素质量比为4:5 | ||
| C. | 含氧原子个数比为5:6 | D. | 含硫原子个数比为5:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属 | |
| B. | 0.1 mol24Mg32S晶体中所含中子总数为2.8 NA | |
| C. | 常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将少量硫酸铝溶液滴入氢氧化钠中 | 制备氢氧化铝 |
| B | 向碘化亚铁溶液中滴加酸化的双氧水 | 验证:氧化性H2O2>Fe3+ |
| C | 向CH2=CHCH2OH中滴加酸性重络酸钾溶液 | 证明有机物中含有羟基 |
| D | 室温下,测定0.1mol•L-1NaX、NaY溶液的pH | 探究HX、HY的电离常数大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com