【答案】
分析:Ⅰ.(1)抓住除钡离子要放在除碳酸根离子前即可解答;根据有机物的性质以及氯化钾在有机物中的溶解度知识来回答;
(2)电解饱和食盐时阳极阴离子Cl
-、OH
-放电,Cl
-的放电能力强于OH
-,阳极发生的方程式为:2Cl
--2e
-═Cl
2↑,阴极:2H
++2e
-═H
2↑;H
2、2NaOH在阴极,NaOH溶液的出口为a,Cl
2在阳极,精制饱和食盐水从阳极进入,要干燥Cl
2需要用酸性干燥剂或中性干燥剂;
Ⅱ.(1)SiCl
4与H
2和O
2反应,产物有两种,光导纤维的主要成分是SiO
2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可;
(2)利用三段分析法,根据平衡时H
2与SiHCl
3物质的量浓度,求出的起始物质的量,再根据2NaCl+2H
2O

Cl
2↑+H
2↑+2NaOH,求出理论上消耗纯NaCl的质量;
(3)根据制取气体的药品和条件来选择仪器和装置;
(4)根据得失电子守恒,NaCl转化为NaClO
3所失去的电子等于H
2O转化为H
2所得到的电子,由氯酸钠的质量求出氯酸钠的物质的量,进而求出NaCl转化为NaClO
3所失去的电子的物质的量,最后求出生成氢气在标准状况下的体积;
Ⅲ.(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;
(2)根据MgCO
3、CaMg(CO
3)
2、Al
2O
3、Fe
2O
3能与硫酸反应,生成了MgSO
4、CaSO
4、Al
2(SO
4)
3和Fe
2(SO
4)
3,其中CaSO
4微溶,形成滤渣;滤液中含有MgSO
4、Al
2(SO
4)
3和Fe
2(SO
4)
3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe
3+和Al
3+已经完全沉淀,滤渣I的主要成分是Fe(OH)
3、Al(OH)
3;
(3)根据侯德榜制碱法生成NaHCO
3的原理;
(4)根据侯德榜制碱法生成NaHCO
3的原理.
解答:解:Ⅰ.(1)应先加入过量BaCl
2,除去SO
42-,然后加过量Na
2CO
3,可除去Ca
2+、Mg
2+、Fe
3+等,过滤后加入盐酸可除去Na
2CO
3,故答案为:③①②;
除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl
4有毒,同时KCl也不会溶解在CCl
4中,用饱和Na
2CO
3溶液或饱和K
2CO
3溶液会引入新的杂质,故答案为:③;
(2)电解饱和食盐时,阴极:氢离子放电,产生氢气,致使氢氧根离子浓度增大,钠离子和氢氧根离子的增大都发生在阴极室,所以a出口导出的液体是氢氧化钠溶液;阳极:氯离子放电,产生氯气,致使钠离子浓度升高,通过阳离子交换膜到达阴极室.所以d入口应加入精制饱和食盐水;要干燥Cl
2需要用酸性干燥剂浓硫酸或P
2O
5等,中性干燥剂无水CaCl
2,
故答案为:氯气;a;d;浓硫酸;
Ⅱ.(1)SiCl
4与H
2和O
2反应,产物有两种,光导纤维的主要成分是SiO
2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可.发生的化学方程式为:SiCl
4+2H
2+O
2
SiO
2+4HCl;
(2)由3SiCl
4(g)+2H
2(g)+Si(s)

4SiHCl
3(g)
起始量(mol) n 0
变化量(mol) 2x x 4x
平衡量(mol) n-2x 4x
4x=0.020mol/L×20L=0.4mol,x=0.1mol,
n-2x=0.140mol/L×20L=2.8mol,n=3.0mol,
由2NaCl+2H
2O

Cl
2↑+H
2↑+2NaOH,
mol 1mol
n(NaCl) 3.0mol
n(NaCl)=6.0mol,m(NaCl)=58.5g/mol×6.0mol=351g=0.351kg,故答案为:0.351;
(3)实验室制氢气:固体+液体
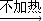
气体,所以选e,制氯气:固体+液体

气体,干燥氯气用浓硫酸,除去氯化氢用饱和食盐水,故选d,故答案为:e,d;
(4)由NaCl转化为NaClO
3,失去电子数为6,H
2O转化为H
2,得到的电子数为2,
设产生的H
2体积为Vm
3,由得失电子守恒得:6×
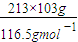
=2×
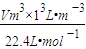
,V=134.4m
3,故答案为:134.4;
Ⅲ.(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,故答案为:适当提高反应温度、增加浸出时间;
(2)因MgCO
3、CaMg(CO
3)
2、Al
2O
3、Fe
2O
3能与硫酸反应,生成了MgSO
4、CaSO
4、Al
2(SO
4)
3和Fe
2(SO
4)
3,其中CaSO
4微溶,形成滤渣;滤液中含有MgSO
4、Al
2(SO
4)
3和Fe
2(SO
4)
3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe
3+和Al
3+已经完全沉淀,滤渣I的主要成分是Fe(OH)
3、Al(OH)
3,
故答案为:Fe(OH)
3、Al(OH)
3;
(3)反应MgCl
2+2NaClO
3═Mg(ClO
3)
2+2NaCl类似于侯德榜制碱法生成NaHCO
3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO
3)
2的方向进行,
故答案为:在某一温度时,NaCl最先达到饱和析出;Mg(ClO
3)
2的溶解度随温度变化的最大,NaCl 的溶解度与其他物质的溶解度有一定的差别;
(4)同样是依据①的原理,在降温的过程中,Mg(ClO
3)
2的溶解度不断减小,从溶液中析出,在生成Mg(ClO
3)
2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO
3)
2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO
3)
2过程中一定会析出氯化钠.由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离.
故答案为:降温前,溶液中NaCl已达饱和,降低过程中,NaCl溶解度会降低,会少量析出;重结晶.
点评:本题考查电解、氯碱工业、化学平衡的计算、化学方程式书写、化学计算、仪器装置的选取等知识点,注意氧化还原反应中电子守恒法的运用.


 Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量;
Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量; SiO2+4HCl;
SiO2+4HCl; 4SiHCl3(g)
4SiHCl3(g) Cl2↑+H2↑+2NaOH,
Cl2↑+H2↑+2NaOH,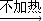 气体,所以选e,制氯气:固体+液体
气体,所以选e,制氯气:固体+液体 气体,干燥氯气用浓硫酸,除去氯化氢用饱和食盐水,故选d,故答案为:e,d;
气体,干燥氯气用浓硫酸,除去氯化氢用饱和食盐水,故选d,故答案为:e,d;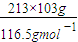 =2×
=2×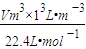 ,V=134.4m3,故答案为:134.4;
,V=134.4m3,故答案为:134.4;

 名校课堂系列答案
名校课堂系列答案
