
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
分析 A.HF为弱酸,不能完全电离;
B.Ksp(CaF2)与温度有关;
C.Qc=c2(F-)×c(Ca2+),Qc<Ksp无沉淀;
D.Qc>Ksp时生成沉淀.
解答 解:A.HF酸为弱酸,不能完全电离,则25℃时,0.1 mol•L-1HF溶液中pH>1,故A错误;
B.Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故B错误;
C.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{Ka×c(HF)}$=6×10-3mol/L,则Qc=c2(F-)•c(Ca2+)=(6×10-3mol/L)•0.1 mol•L-1=6×10-4>Ksp,说明有沉淀产生,故C错误;
D.由选项C可知,Qc>Ksp,说明有沉淀产生,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握弱电解质的电离、沉淀的生成为解答的关键,侧重分析与应用能力的考查,注意Qc与Ksp的关系及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 水溶液中能电离出H+的化合物叫做酸 | |
| B. | 实验测得2mol某气体体积为44.8L,则测定条件一定是标准状况 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯使溴水褪色的原因不同 | |
| B. | 苯和氢气在一定条件下生成环己烷的反应为还原反应 | |
| C. | 硝基苯和乙酸乙酯的制备都发生了取代反应 | |
| D. | 由乙醇制取乙烯发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$\frac{{H}_{2}}{高温}$Si | |
| B. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH${\;}_{{\;}_{3}}$$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | FeS$\stackrel{HCl(aq)}{→}$H2S$→_{煅烧}^{O_{2}}$SO2$→_{点燃}^{氧气}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
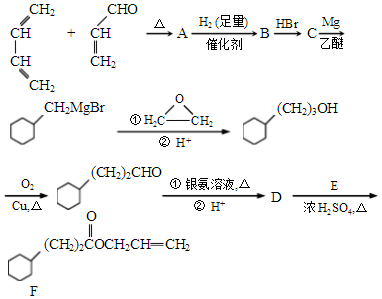
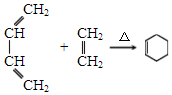
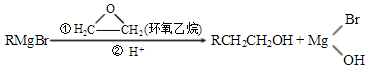
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
.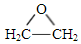 )为原料制备1丁醇,设计合成路线
)为原料制备1丁醇,设计合成路线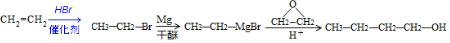 (其它试剂任选).(合成路线常用表示方法为:A $→_{反应条件}^{反应试剂}$ B …$→_{反应条件}^{反应试剂}$目标产物)
(其它试剂任选).(合成路线常用表示方法为:A $→_{反应条件}^{反应试剂}$ B …$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 催化液化I中使用催化剂,反应的活化能Ea、△H2都减小 | |
| B. | 反应C(s)+H2O(g)+H2(g)=CH3OH(g)△H=41.1 kJ•mol-1 | |
| C. | △H2>△H3 | |
| D. | 图为甲醇燃料电池的工作原理,负极的电极反应为:CH3OH-6e-+6OH-═CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L氢氧化钠溶液 | B. | 0.1mol/L氢氧化钡溶液 | ||
| C. | 0.1mol/L氢氧化钾溶液 | D. | 0.1mol/L氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 同分异构体的结构简式.
同分异构体的结构简式.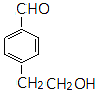 、
、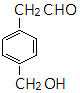 .
.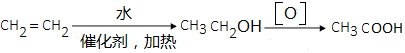 .(无机试剂可以任选)
.(无机试剂可以任选)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 副族元素中没有非金属 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | ⅠA族的所有元素都为金属元素 | |
| D. | 同周期ⅡA族与ⅢA族元素原子序数相差只有1、11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com