
【题目】工业上利用CO与H2反应合成优质燃料甲醇。
(1)已知燃烧6.4g甲醇放出145.16kJ热量,请写出表示甲醇燃烧热的热化学方程式:_______。
(2)甲醇燃料电池具有能量密度大,对环境污染小等优点,有一种甲醇碱性燃料电池装置如图所示:
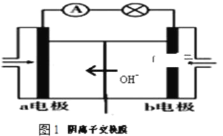
①甲醇应由______(选填“a”或“b”)极通入,其电极反应式为___________;
②当电路中通过1.2mol电子时,a极室n(OH-)减少____________mol;
(3)已知:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。
CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。

a.温度:T1>T2>T3
b.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
c.正反应速率:v(a)<v(c)、v(b)>v(d)
d.平衡常数:K(a)<K(c)、K(b)=K(d)
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=725.8kJmol1 a CH3OH-6e-+8OH-=CO32-+6H2O 0.4mol bc
O2(g)=CO2(g)+2H2O(l)△H=725.8kJmol1 a CH3OH-6e-+8OH-=CO32-+6H2O 0.4mol bc
【解析】
(1)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,其中C→CO2(g),H→H2O(l),根据燃烧6.4g甲醇放出145.16kJ热量,计算燃烧1mol甲醇放出的热量,进而写出甲醇燃烧热的热化学方程式;
(2)①原电池中阴离子移动向负极,则a电极为负极,而燃料电池中通入甲醇的一极为负极,则甲醇应由a极通入,电解质环境为碱性环境,则甲醇失电子后生成碳酸根离子;
②负极电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,正极通入氧气,在碱性环境下,正极的电极反应式为O2+4e- +2H2O=4OH-,根据两极OH-的变化结合离子移动判断a极室n(OH-)减少的物质的量;
(3)a. 该反应为放热反应,降温平衡正向移动,CO平衡转化率增大;
b. 平均摩尔质量![]() ,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则
,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则![]() 与
与![]() 成反比;
成反比;
c. 温度越高,反应速率越大,压强越大,反应速率越大;
d. 平衡常数只与温度有关,该反应为放热反应,降温平衡正向移动,平衡常数增大。
(1)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,其中C→CO2(g),H→H2O(l),已知燃烧6.4g甲醇放出145.16kJ热量,则燃烧1mol甲醇放出![]() 的热量,燃烧反应为放热反应,则甲醇燃烧热的热化学方程式为:CH3OH(l)+
的热量,燃烧反应为放热反应,则甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
(2)①原电池中阴离子移动向负极,则a电极为负极,而燃料电池中通入甲醇的一极为负极,则甲醇应由a极通入,电解质环境为碱性环境,则甲醇失电子后生成碳酸根离子,其电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:a;CH3OH-6e-+8OH-=CO32-+6H2O;
②负极电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,正极通入氧气,在碱性环境下,正极的电极反应式为O2+4e- +2H2O=4OH-,当电路中通过1.2mol电子时,负极消耗OH-为1.6mol,生成碳酸根离子0.2mol,正极生成1.2mol OH-,为平衡电荷,正极生成的这1.2mol OH-会移动向负极,则a极室n(OH-)减少为1.6mol-1.2mol=0.4mol;
故答案为:0.4mol.;
(3)a. 该反应为放热反应,降温平衡正向移动,CO平衡转化率增大,则温度:T1<T2<T3,A项错误;
b. 平均摩尔质量![]() ,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则
,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则![]() 与
与![]() 成反比,a点和c点相比,a点的CO平衡转化率比c点大,则a点正向进行程度更大,气体物质的量更小,则M(a)>M(c);同理可得,M(b)>M(d),B项正确;
成反比,a点和c点相比,a点的CO平衡转化率比c点大,则a点正向进行程度更大,气体物质的量更小,则M(a)>M(c);同理可得,M(b)>M(d),B项正确;
c. 温度越高,反应速率越大,压强越大,反应速率越大,a点和c点相比,压强相等,温度T1<T3,则正反应速率:v(a)<v(c);b点和d点相比,温度相等,压强Pb>Pd,则v(b)>v(d),C项正确;
d. 平衡常数只与温度有关,该反应为放热反应,降温平衡正向移动,平衡常数增大,由A项知,T1<T2<T3,则平衡常数:K(a)>K(b)=K(d)>K(c),D项错误;
故答案为:bc。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()

A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一密闭容器中充入2mol HI气体,发生反应:2HI(g) ![]() H2(g)+I2(g) ΔH>0 ,达到化学平衡状态后,为使体系颜色加深,可采取的措施是( )
H2(g)+I2(g) ΔH>0 ,达到化学平衡状态后,为使体系颜色加深,可采取的措施是( )
①维持温度和容器体积不变,再充入少量I2(g) ②维持温度和压强不变,再充入2molHI ③降低温度 ④加压(缩小容器体积) ⑤升高温度
A.①④⑤B.②③C.②③④D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将 | 先无现象后产生白色胶状沉淀 |
|
B | 向2支盛有醋酸和硼酸溶液的管中分别滴加 | 醋酸:产生气泡; 硼酸:无现象 |
|
C | 将少量 | 沉淀由红褐色变为白色 |
|
D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,相同pH的两种一元酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
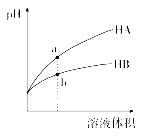
A. HA一定是强酸
B. a点溶液的导电性大于b点溶液
C. a点的c(HA)大于b点的c(HB)
D. HA的酸性强于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用100 mL 1 mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化)。为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验。请帮助他们完成下列相应实验内容。
[提出假设]
假设Ⅰ:溶液A的溶质为NaOH、Na2CO3;
假设Ⅱ:溶液A的溶质为Na2CO3;
假设Ⅲ:溶液A的溶质为Na2CO3、NaHCO3;
假设Ⅳ:溶液A的溶质为___。
[实验过程]
(1)甲同学取少量溶液A于试管,再向试管中滴加几滴酚酞溶液,溶液A变红,由此得出假设I成立。
(2)乙同学分析后认为甲同学的实验结论有误。请用离子方程式说明乙同学的判断依据_____;他进一步提出,应先取少量溶液,向其中加入足量的___溶液,来检验溶液A是否含___,结果加入检验溶液后观察到溶液A变浑浊。
(3)丙同学为了检验溶液A是否还含其它溶质,他将乙同学所得浑浊溶液进行过滤,并把滤液分为两份,向其中的一份加入稀硫酸,有无色气体生成,则假设___正确。
(4)为准确测定a值,丁同学取了10 mL 溶液A在锥形瓶中,用滴定管向其中加入某浓度的稀硫酸,记录加入硫酸的体积与生成气体的情况,并绘制成如图:

则a=___,所加硫酸的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国电池的年市场消费量约为80亿只,其中![]() 是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体
是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体![]() 和纯
和纯![]() 的工艺如下图所示:
的工艺如下图所示:

已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为![]() 、
、![]() 、
、![]() 、碳粉等,还含有少量的Cu、Ag、Fe等。
、碳粉等,还含有少量的Cu、Ag、Fe等。
②![]() ;
;![]() ;
;![]() 。
。
(1)除去炭包中碳粉的操作为________。
A.酸浸 ![]() 过滤
过滤 ![]() 焙炒
焙炒 ![]() 焙烧
焙烧
(2)粗![]() 转化为
转化为![]() 时,主要反应的离子方程式为____________________________。
时,主要反应的离子方程式为____________________________。
(3)焙烧时发生反应的化学方程式为__________________________________________。
(4)制备硫酸锌晶体流程中,在溶解时加![]() 的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体
的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体![]() 的一系列操作为:____________、____________、________、洗涤、干燥。
的一系列操作为:____________、____________、________、洗涤、干燥。
(5)“草酸钠![]() 高锰酸钾返滴法”可测定
高锰酸钾返滴法”可测定![]() 的纯度,取
的纯度,取![]() 样品于锥形瓶中,加入适量稀硫酸,再加入足量的
样品于锥形瓶中,加入适量稀硫酸,再加入足量的![]() 溶液,最后用
溶液,最后用![]() 溶液滴定剩余的
溶液滴定剩余的![]() 。其中
。其中![]() 与
与![]() 溶液反应的离子方程式为__________________________________________。
溶液反应的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵![]() 加入密闭容器中,发生反应
加入密闭容器中,发生反应![]() 。该反应的平衡常数的负对数
。该反应的平衡常数的负对数![]() K
K![]() 值随温度
值随温度![]() T
T![]() 的变化曲线如图所示,下列说法错误的是
的变化曲线如图所示,下列说法错误的是
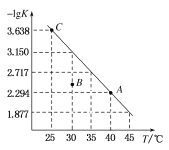
A.C点对应状态的平衡常数 K( C )![]()
B.该反应的![]() H
H ![]()
C.![]() 的体积分数不变时,该反应一定达到平衡状态
的体积分数不变时,该反应一定达到平衡状态
D.30℃时, B点对应状态的 v![]() 正
正![]() v
v![]() 逆
逆![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com