将190g MgCl2溶于水配制成1L溶液.
(1)该溶液中MgCl2的物质的量浓度为______mol?L-1.
(2)配制1mol?L-1的MgCl2溶液500mL,需上述溶液的体积为______ mL.
(3)向(2)中500mL溶液中再通入一定量的HCl气体后,使溶液中Cl-的物质的量浓度变为3mol?L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为______mol?L-1,通入HCl气体的体积(标准状况下)为______L.
解:(1)n(MgCl
2)=
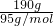
=2mol,c(MgCl
2)=
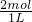
=2mol/L,故答案为:2;
(2)溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀),设配制1mol?L
-1的MgCl
2溶液500mL,需上述溶液的体积为V,
则:0.5L×1mol/L=V×2mol/L,V=0.25L,即250ml,故答案为:250;
(3)向(2)中500mL溶液中再通入一定量的HCl气体后,使溶液中Cl
-的物质的量浓度变为3mol?L
-1(假设溶液体积不变),溶液中阳离子所带电荷等于阴离子所带电荷,则
c(H
+)+2c(Mg
2+)=c(Cl
-)+c(OH
-),由于溶液呈酸性,则c(OH
-)较小,可忽略不计,
则:c(H
+)=c(Cl
-)-2c(Mg
2+)=3mol/L-2×1mol/L=1mol/L,
n(HCl)=n(H
+)=0.5L×1mol/L=0.5mol,
V(HCl)=0.5mol×22.4L/mol=11.2L,
故答案为:1;11.2.
分析:(1)根据c=

计算MgCl
2的物质的量浓度;
(2)根据c(浓)×V(浓)=c(稀)×V(稀)计算;
(3)利用溶液的电中性原则解答.
点评:本题考查物质的量浓度的计算,题目难度不大,注意溶液稀释前后溶质物质的量不变的特点以及溶液电中性原则的利用.

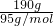 =2mol,c(MgCl2)=
=2mol,c(MgCl2)=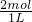 =2mol/L,故答案为:2;
=2mol/L,故答案为:2; 计算MgCl2的物质的量浓度;
计算MgCl2的物质的量浓度;


