
【题目】根据能量变化示意图得出的结论正确的是( )
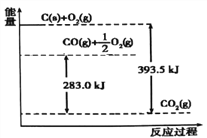
A. 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol
B. 2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol
C. 2CO2 (g)=2CO(g)+O2(g) △H=+283.0 kJ/mol
D. C(s)+O2(g)= CO2 (g) △H=+393.5 kJ/mol
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
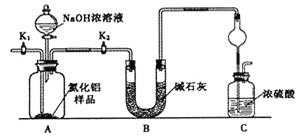
(1)上图装置中,U形管B中所装固体为________,C中球形干燥管的作用是_______________________。
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________________________________。
(3)由于上述装置还存在____________缺陷,导致测定结果偏高。
【方案2】按以下步骤测定样品中AlN的纯度:
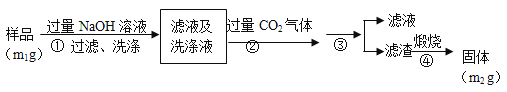
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作中用到的主要玻璃仪器是_________。AlN的纯度是__________(用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年世界环境日的主题为:Think.Eat.Save. ——思前、食后、厉行节约。爱护环境,呵护地球是我们每一个人不可推卸的责任。下列现象与污染源对应不正确的是
A. 酸雨——硫的氧化物、氮的氧化物 B. 光化学烟雾——氮的氧化物
C. 臭氧空洞——氟氯烃(即氟利昂) D. 温室效应——SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
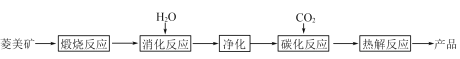
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验
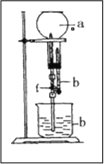
(f为止水夹)
请回答下列问题:
(1)写出实验室制取氨气的化学方程式 ___________________。
(2)要得到干燥的氨气可选用______ 作干燥剂。
A、浓硝酸 B、浓硫酸
C、碱石灰(CaO和NaOH的混合物) D、氢氧化钠溶液
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:![]()
已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则反应I的热化学方程式为________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) △H>0,请你分析该设想能否实现?______(填“是”或“否”) ,依据是_____________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
① 甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因___________。
② 向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈______性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为______________。
(4)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
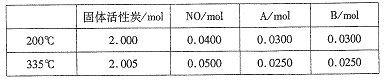
①该反应的正反应为________(填”吸热”或“放热”)反应。
② 200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将_____。(填“增大”、“减小”或“不变”)。
③计算反应体系在335℃ 时的平衡常数_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在化学晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字.该学生先后所用的无色液体可能是
A.石蕊溶液、稀硫酸 B.NaOH溶液、酚酞溶液
C.酚酞溶液、“雪碧”饮料 D.CuSO4溶液、NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com