
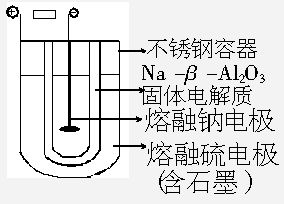
 作无噪音、无污染、价廉、安全、使用寿命长以及维修费用低等特点。常用的电池是由液体电解质将两个固体电极隔开,而Na-S电池正好相反,它是由固体电解质将两个液体电极隔开:一个由Na-β-Al2O3固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点113℃)隔开,并允许电子通过。整个装置密封于不锈钢容器内,此容器又兼作硫电极的集流器。在电池内部,电子穿过固体电解质和硫反应从而传递电流。350℃时,Na-S电池的断路电压为2.08V。已知该硫的化学式为S8,在外电路中被还原成多硫离子。
作无噪音、无污染、价廉、安全、使用寿命长以及维修费用低等特点。常用的电池是由液体电解质将两个固体电极隔开,而Na-S电池正好相反,它是由固体电解质将两个液体电极隔开:一个由Na-β-Al2O3固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点113℃)隔开,并允许电子通过。整个装置密封于不锈钢容器内,此容器又兼作硫电极的集流器。在电池内部,电子穿过固体电解质和硫反应从而传递电流。350℃时,Na-S电池的断路电压为2.08V。已知该硫的化学式为S8,在外电路中被还原成多硫离子。见解析
解析:本题考查了蓄电池的一些性质,充电时电能转化为化学能,可看作电解池;放电时化学能转化为电能,可看作原电池。在充、放电的过程中,反应物和产物可以相互转化。
(1)高温下,钠与硫均为熔融态,因此Na-S电池充、放电时的化学方程式为: Na2Sn 2Na (l) +
2Na (l) + S8(l)。
S8(l)。
(2)Na-S电池放电时为原电池,失电子发生氧化反应的为负极,得电子发生还原反应的为正极,因此放电时,Na为负极:16Na-16e-=16Na+,S为正极:nS8+16e-= 。
。
(3)内室的熔融钠放出电子,通过外电路将硫还原成多硫离子 ,但由于硫是绝缘体,故在外室填充多孔石墨增强导电性,以保证有效导电。
(4)由于Na-S电池在350℃时的断路电压为2.08V,即电池的电动势为2.08V,故可以用电压表测定Na-S电池的电动势。即放电时,电动势降至某额定限量即停止放电;充电时,电动势升至某额定限量(2.08V)即停止充电。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
.以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,电池反应为:
有关下列说法错误的是( )
A.氨燃料电池在放电时,氨气被氧化
B.氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH- N2+6H2O
C.以氨气代替氢气的主要原因是:氨气易液化易储存
D.燃料电池的能量转化率一般比普通的电池高
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三上学期期末考试化学试卷(解析版) 题型:填空题
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 ?????????????????????????????????????????????????????????????????? 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s)??? ? △H=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)? △H=+116.5 kJ·mol-1
③H2O(1)=H2O(g)? ??????????????????? △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式?????????????????
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为??????????????? ;每消耗3.4g NH3转移的电子数为??????????????? (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)? △H=Q kJ·mol-1。
N2(g)+CO2(g)? △H=Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
???????? 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ????? ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是? ?? ? (填字母编号)。
a.加入一定量的活性炭 ???? b.通人一定量的NO
c.适当缩小容器的体积?????? d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q ??? 0(填“>”或“<”)。?
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一下学期三调考试化学试卷(解析版) 题型:选择题
.以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,电池反应为:

有关下列说法错误的是( )
A.氨燃料电池在放电时,氨气被氧化
B.氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH-
N2+6H2O
C.以氨气代替氢气的主要原因是:氨气易液化易储存
D.燃料电池的能量转化率一般比普通的电池高
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省高三第一次统考理科综合试卷化学部分(解析版) 题型:选择题
以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,电池反应为:

有关下列说法错误的是( )
A.氨燃料电池在充电时,OH-向电池的负极移动
B.氨燃料电池在放电时,负极反应为:2NH3-6e-+6OH-
N2+6H2O
C.以氨气代替氢气的主要原因是:氨气易液化易储存
D.燃料电池的能量转化率一般比普通的电池高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com